Токсины Bacillus thuringiensis, Общая характеристика и структура токсинов - Характеристика пестицидных белков Bacillus thuringiensis и их генетических детерминант
Общая характеристика и структура токсинов
Токсины, продуцируемые BT, представляют собой белки с молекулярной массой от 130 до 140 кДа либо около 70 кДа для Сry-токсинов (Pigott, Ellar, 2007), 100 или 88 кДа для Vip-токсинов(Lee et al., 2003), 26-28 либо 60 кДа для Cyt-токсинов (Manasherob et al., 2003).
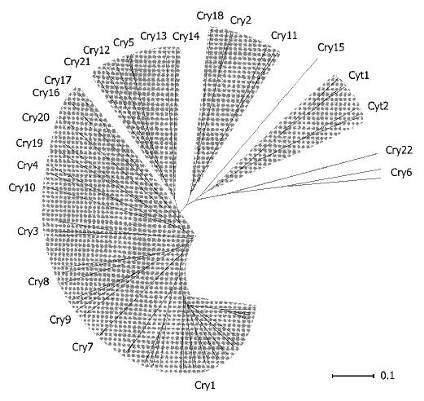
Рис.1. Группы Cry - и Cyt-белков, выделенные на основании сходства их аминокислотных последовательностей и представленные графически в виде радиальной филлограммы. Группы сходства заштрихованы. (По Schnepf et al., 1998, на основании данных Crickmore et al., 1998)
Принятая в настоящее время классификация токсинов основана на степени сходства их консервативных аминокислотных последовательностей, первичной и вторичной структуры (Crickmore et al., 1998; Schnepf et al., 1998), что отражает эволюционную дивергенцию между подвидами и штаммами. (Добрица и др., 2001) В соответствии с этим выделяют два мультигенных семейства токсинов: Cry и Cyt (рис.1) (Crickmore et al., 1998)
Следует отметить, что эта система классификации касается тех токсинов, которые продуцируются в период стационарной фазы роста популяции бактериальных клеток, в зависимости или независимо от процесса споруляции, и формируют параспоральные кристаллические включения внутри клетки (рис.2). Таким образом, эти белки следует относить к эндотоксинам.
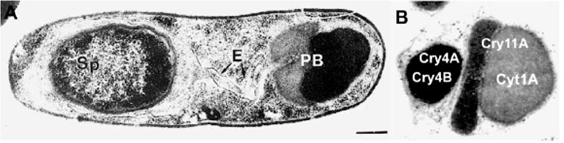
Рис.2. Клетка Bacillus thuringiensis Subsp. Israelensis после споруляции (А) и ее типичное параспоральное тельце с указанием взаиморасположения в нем включений индивидуальных токсинов (В). Sp - спора, Е - экзоспориум, РВ - параспоральное тельце (По Federici et al., 2003)
Протеины групп Cry1, Cry2 и Cry9 токсичны для насекомых отряда Чешуекрылые, а групп Cry3, Cry7 и Cry8 - для представителей отряда Жесткокрылые. Токсины групп Cry2, Cry4, Cry10, Cry11, Cry16, Cry17, Cry19 и Cyt активны в отношении видов отряда Двукрылые, а Cry5, Cry12, Cry13 и Cry14 обладают нематоцидным действием (Bravo et al., 1998).
Однако эндотоксины Cry - и Cyt-семейств - далеко не единственные факторы, обусловливающие пестицидную активность ВТ: определенный вклад вносят также фосфолипазы, протеазы, хитиназы, продуцируемые ВТ, а также пестицидные белки (VIP-белки), продуцируемые некоторыми штаммами ВТ на протяжении фазы вегетативного роста (Добрица и др., 2001; Schnepf et al., 1998). Аббревиатура VIP (vegetative insecticidal protein) отражает особенности их синтеза (во время периода вегетативного роста), хотя при таком рассмотрении данный термин не вполне корректен, поскольку некоторые Cry-токсины также продуцируются в фазе вегетативного роста (Schnepf et al., 1998). В связи с широким и длительным использованием биопестицидов на основе именно д-эндотоксинов и приобретением многими видами насекомых устойчивости к ним (Tabashnik, 1997; Onstad, 2008), подробное изучение VIP-токсинов перспективно в плане их использования как альтернативы препаратам на основе Cry-протеинов. VIP-протеины не обнаруживают никакого сходства по первичной, вторичной и третичной структуре с белками семейств Cry и Cyt, для них существует отдельная номенклатура, в соответствии с которой они объединены в 3 семейства: Vip1, Vip2, Vip3. Белки Vip1 и Vip2 - компоненты бинарного токсина, активного в отношении представителей отряда Coleoptera (Rang et al., 2005).
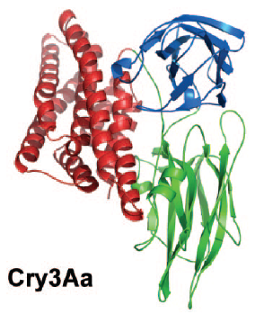
Рис.3. Трехмерная кристаллическая структура Cry-токсинов на примере Cry3Aa и Cry1Aa. Домен I показан красным цветом, домен II - зеленым, домен III - синим. (По Pigott, Ellar, 2007)
Все токсины Cry-семейства - белки, состоящие из трех основных функционально значимых единиц - доменов. Каждый домен имеет специфический аминокислотный состав, вторичную и третичную структуру (рис.3).
Домен I представляет собой связку б-спиралей, в которой шесть спиралей окружают одну центральную спираль. Каждая из этих шести внешних спиралей имеет амфипатическую природу (т. е. имеет и гидрофильную, и гидрофобную части). Заряженные или полярные остатки, как правило, расположены на тех частях домена, которые контактируют с растворителем, а гидрофобные остатки, обычно ароматической природы, находятся на частях, обращенных к центральной б-спирали. Полярные группы представлены в межспиральном пространстве, но все они участвуют в образовании водородных связей или солевых мостиков (Schnepf et al., 1998; Pigott, Ellar, 2007). Следует отметить, что структура домена I сходна с таковой у порообразующего домена колицина. Домен I - главный детерминант процесса образования пор в плазматической мембране, например, мембране ворсинок эпителиальных клеток кишечника насекомых, он способен встраиваться в липидный бислой мембраны, пронизывая его (Schnepf et al., 1998; Pigott, Ellar, 2007).
Домен II образован тремя антипараллельными в-слоями, упакованными воедино так, что они формируют в-призму с псевдотрехлучевой симметрией. Два из этих слоев обращены по направлению к окружающему молекулу токсина растворителю (т. е. наружу), а третий располагается рядом с доменом I. По своей структуре домен II проявляет наибольшую вариабельность среди всех трех доменов Cry-токсинов, это особенно справедливо для трех верхушечных петель домена II, структура и роль которых в настоящее время интенсивно изучаются (Pigott et al., 2008). Домен II играет главную роль в определении специфичности действия токсина, связываясь с определенным рецептором на плазматической мембране (Schnepf et al., 1998; Pigott, Ellar, 2007). Важная роль петель в специфическом связывании токсина была, например, подтверждена путем мутагенеза в последовательности размером 30 нуклеотидов, которая кодирует последовательность аминокислот домена II, при этом лишь мутации, затрагивающие сериновые остатки, расположенные в области петель, приводили к выраженному снижению токсичности продукта такого мутантного гена для личинок насекомых (Aronson et al., 1995). Направленный мутагенез был использован и для редизайна CryIAa токсина, активного в отношении гусениц-вредителей, в токсин, действующий против москитов (Liu, Dean, 2006). Это было сделано путем делеций и замены нуклеотидов в последовательности, кодирующей аминокислотную последовательность петли домена II.
Домен III сформирован "сэндвичем" из двух антипараллельных в-слоев, в котором внешний слой обращен к окружающему молекулу белка растворителю, а внутренний располагается рядом с доменом II. Две длинные петли отходят от одного конца домена III и взаимодействуют с доменом I. Домен III с отходящими от него петлями образует уникальный сайт связывания с определенными углеводами, на основании чего полагают, что он усиливает действие токсина путем повышения его эффективной концентрации на поверхности субстрата, т. е. плазматической мембраны (Schnepf et al., 1998; Pigott, Ellar, 2007).
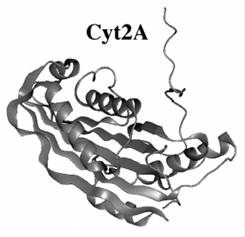
Рис.4. Трехмерная структура Cyt-токсинов на примере Cyt2A (По Schnepf et al., 1998)
Что касается структуры Cyt-токсинов, то они, в отличие от Cry-токсинов, состоят из единственного домена (рис.4), в котором два внешних слоя б-спиралей окружают смешанный в-слой (Schnepf et al., 1998).
Нельзя не обратить внимание на тот факт, что положение определенных аминокислотных остатков в доменах молекул токсинов является консервативным и функционально важным, например, для Cry-протеинов выявлены восемь остатков триптофана, замена которых на другие аминокислотные остатки путем сайт-специфического мутагенеза соответствующих Cry-генов приводит к снижению токсичности таких мутантных белков для насекомых (Padilla et al., 2006).
Похожие статьи
-
Bacillus thuringiensis (BТ) относится к грамположительным аэробным спорообразующим эубактериям палочковидной формы и принадлежит к сем. Bacillaceae . Это...
-
Введение - Характеристика пестицидных белков Bacillus thuringiensis и их генетических детерминант
Объектом данной курсовой работы является Bacillus thuringiensis , а предметом - использование данного вида эубактерий как продуцента хозяйственно...
-
Первичная структура - понятие, обозначающее последовательность аминокислотных остатков в белке Пептидная связь - основной вид связи, определяющий...
-
Непременным компонентом вирусной частицы является какая-либо одна из двух нуклеиновых кислот, белок и зольные элементы. Эти три компонента являются...
-
Характеристика пептидной связи - Первичная структура белков
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна....
-
- создают онкотическое давление крови, от которого зависит обмен воды между кровью и межклеточной жидкостью; - определяют вязкость крови, что в свою...
-
Благодаря постоянному и беспорядочному броуновскому движению молекул воды [4] две идентичные по всем параметрам биомолекулы (БМ) способны не только...
-
1996 г. 1997 г. 1998 г. В 1997-1998 годах нагрузка на лабораторию уменьшилась с 247,7 % до 130,9 %, а на одного врача - в 2,1 раза, но, однако, все еще...
-
Непременным компонентом вирусной частицы является какая-либо одна из двух нуклеиновых кислот, белок и зольные элементы. Эти три компонента являются...
-
Сразу же отметим, что изменить положение своей БД для ответа на изменение внешней среды в водах с замедленным течением и тем более - в стоячих водах...
-
Генетический код - Великие открытия в генетике ХХ века
РНК передает инструкции от ДНК для создания белка. Но каков генетический код - последовательность инструкций, которая делать этот процесс возможным? В...
-
Именно броуновское движение органических молекул в водной среде является причиной не только самоорганизации БС, но и их самовосстановления....
-
Вода и растворенные в ней вещества, числе минеральные соли, создают внутреннюю среду организма, свойства к-й сохраняются постоянными или изменяются...
-
Морская свинка обладает 32-мя парами хромосом. Таким образом получаем что общее число хромосом у морской свинки 64 шт о своему генотипу морские свинки...
-
Витамины (от лат. vita -- "жизнь" и амин) -- группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической...
-
Различают два основных класса подвижных элементов: Транспозоны и Ретротранспозоны. Такая классификация основана на молекулярных механизмах, с помощью...
-
Удельный вес положительных проб в структуре санитарных исследований за 3 года 1996 1997 1998 - смывы, всего 5,45 4,65 4,65 В т. ч. - хирургические...
-
Обычно гликозиды классифицируют по типу агликона. Основные классы гликозидов перечислены ниже. Тиольные гликозиды (тиоцианатные, изотиоцианатные, сульфо...
-
Плазма крови - это раствор, состоящий из воды (90-92%) и сухой остаток (10 - 8%), состоящий из органических и неорганических веществ. (рис. 1)...
-
Регуляция синтеза гема, Нарушения синтеза гема - Порфирии - Первичная структура белков
Регуляторными ферментами являются АЛК (аминолевулинатсинтетаза) и Аминолевулинатдегидрогеназа. АЛК - синтаза является главным регуляторным ферментом,...
-
Замена аминокислоты на поверхности гемоглобина А - Первичная структура белков
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 в-цепи, в которых глутамат, высокополярная отрицательно заряженная...
-
Основные свойства фитоценозов В данном разделе рассматриваются только естественные фитоценозы и при этом коренные, или климаксовые (объяснение этого...
-
Введение, Общая характеристика сердечной мышечной ткани - Характеристика сердечной мышечной ткани
В современной медицине все больший интерес вызывают вопросы лечения и профилактики заболеваний сердечно-сосудистой системы, возникновение которых в...
-
Заключение - Биосинтез белков. Ген и его роль в синтезе белков
В ходе написания курсовой работы мне удалось выяснить что биосинтез белков осуществляется во всех клетках про - и эукариот. Информация о первичной...
-
Определено расположение субъединиц в геномах вирусов, прокариотов и эукариотов, послужившее основой для создания универсального генетического кода....
-
К чистым факторам переноса относят, например, факторы F и F-подобные (pAP22-4, pAP38, pAP39, pAP41) и pTRA1, фактор T, идентифицированный в E. coli,...
-
Шерсть - Общая характеристика кошек
У дикой кошки четыре типа шерсти: нижняя (подшерсток), остевая, предохраняющая и осязательные волоски. На каждом квадратном миллиметре кожи может быть до...
-
Физиологическая роль белка, Структурная функция белка - Строение, функции и значение белков
Структурная функция белка Белки сложные органические соединения, построенные из аминокислот. В состав белковых молекул входят азот, углерод, водород и...
-
Этапы биосинтеза белка, Транскрипция - Биосинтез белков. Ген и его роль в синтезе белков
Транскрипция Мост между геном (кодонами) и белком обеспечивается РНК. Точнее, информация, закодированная в последовательности азотистых оснований ДНК,...
-
Общая характеристика хищных насекомых и паукообразных - Хищные насекомые и паукообразные
Класс Насекомые представляет собой многообразную и широко распространенную группу членистоногих. Известно более миллиона видов насекомых. Они заселили...
-
Что такое бронхиальная астма, Общая характеристика заболевания - Бронхиальная астма
Общая характеристика заболевания Исчерпывающего определения бронхиальной астмы до сих пор не существует. Однако большинство исследователей рекомендуют...
-
Расшифровка генетической информации - ДНК
Полимерные цепи белков состоят из мономерных звеньев - аминокислот и последовательность расположения их в белковой молекуле строго специфична. В связи с...
-
В состав исследуемых 70 рыб входят особи 4-х возрастных групп: двухгодовики - 28 штук (40%), трехгодовики - 23 штуки (32,8%), четырехгодовики - 17 штук...
-
Пауки, Общая характеристика - Пауки и скорпионы
Общая характеристика Пауки - безжалостные убийцы. Поймав жертву в шелковые сети они впрыскивают ей смертоносный яд. Почти все пауки ядовиты, но лишь...
-
Наиболее важной буферной системой плазмы является бикарбонатный буфер, состоящий из слабой угольной кислоты (рК1 6,1) и ее кислого аниона бикарбоната....
-
В настоящее время оценка генетической структуры различных популяций осуществляется с использование биологических и небиологических источников информации,...
-
У холерных вибрионов выделяют Термостабильные О- И термолабильные Н-Аг . О-антигены . По структуре О-антигены выделяют 139 серогрупп; Возбудители холеры...
-
Суставы, или синовиальные соединения, представляют собой прерывные соединения костей, отличающиеся обязательным наличием следующих анатомических...
-
Неудовлетворительное качество питьевой воды по микробиологическим показателям: в 1997 году - 10,65 % нестандартных проб, в 1998 году - 9,5 %; снижение...
-
Характеристики информации - Секреты молекулярной информации
Молекулярная биологическая информация мало чем отличается от других видов кодируемой информации. Ясно, что она выделяется чрезвычайно высокой плотностью...
Токсины Bacillus thuringiensis, Общая характеристика и структура токсинов - Характеристика пестицидных белков Bacillus thuringiensis и их генетических детерминант