Методи ідентифікації лікарських засобів
Аналіз будь-якого ЛП або ЛР починається з доведення того, що маєм справу із тим препаратом, назва якого вказана на маркуванні. Дослідження на тотожність - це підтвердження ідентичності аналізованої ЛР (лікарської форми), що здійснюється на основі вимог Фармакопеї чи іншої нормативно-технічної документації. Випробування виконують фізичними, хімічними і фізико-хімічними методами. З цією метою ДФ пропонує комплекс випробувань, а перелік визначуваних показників міститься в розділі "Опис" кожної ФС. Звичайний набір таких показників:
- *характерний зовнішній вигляд; *розчинність; *температури кипіння, плавлення; *густина; *в'язкість; *температурний інтервал перегонки; *питоме обертання (або кут обертання); *рН водного розчину; *максимум поглинання в УФ або видимої області спектру; *величина відношення оптичних густин при визначеній довжині хвилі; *показник заломлення розчину; *питомий показник поглинання; *хімічні реакції на катіони, аніони і функціональні групи, що обумовлюють фармакологічну активність.
Обов'язковою умовою об'єктивного випробування тотожності ЛР є ідентифікація тих іонів і функціональних груп, що входять в структуру молекул, які обумовлюють фармакологічну активність.
З допомогою фізичних і хімічних констант (питоме обертання, рН середовища, показник заломлення, УФ - та ІЧ-спектру) підтверджуються і інші властивості молекул, які мають вплив на фармакологічних ефект. Хімічні реакції, які застосовуються в фармацевтичному аналізі супроводжуються утворенням забарвлених сполук, виділенням газоподібних чи нерозчинних у воді сполук. Останні можна ідентифікувати за температурою плавлення.
Випробування наведені в розділі ДФУ "ІДЕНТИФІКАЦІЯ" не розраховані на повне підтвердження хімічної структури або складу продукту. Вони призначені для підтвердження з прийнятним ступенем вірогідності того, що продукт відповідає інформації, наведеній на етикетці. У деяких монографіях є підрозділи "Перша ідентифікація" та "Друга ідентифікація". Звичайно використовують першу ідентифікацію. Якщо є гарантія того, що дана серія субстанції була раніше сертифікована на відповідність усім вимогам монографії, випробування з другого підрозділу можуть використовуватися замість випробувань із першою підрозділу.
Способи ідентифікації удосконалюються за рахунок використовування сучасних фізичних і фізико-хімічних методів дослідження (ІЧ-спектроскропії, спектроскопії ядерного магнітного резонансу, електронного парамагнітного резонансу, хроматографічних методів і ін.). Для повноцінного використання таких методів потрібні стандартні зразки ЛР. При встановленні тотожності ЛР шляхом перевірки фізичних властивостей або вимірювання фізичних констант використовуються фізичні методи.
Тотожність лікарської речовини підтверджує відповідність фармакопейним стандартам її агрегатного стану, форми кристалів, смаку, запаху, гігроскопічності, звітрюваності, стійкості до різних зовнішніх дій, леткості, забарвлення і ін. Серед перерахованих характеристик однієї з найбільш важливих для попередньої ідентифікації речовини є її забарвлення, яке звичайно визначається візуально. У деяких випадках при характеристиці забарвлення ЛЗ у фармакопеї вказується на можливість його зміни. Зміна зовнішнього вигляду об'єкту може відбуватися під впливом різних чинників (вологи, повітря, інших газів, освітлення, зміни температури, пилу і ін.) і проявляється як відволоження порошку, утворення осаду, зміна кольору, виділення газу і т. д. В основі цих явищ, як правило, лежать хімічні реакції різних типів. В розділі "Опис" вказується на можливість зміни зовнішнього вигляду ЛЗ при зберіганні (продукти звітрювання і ін.).
Фармакологічні наслідки таких змін можуть виявлятися в порушенні дозування ЛЗ, токсичності, несумісності компонентів в ЛЗ. При зміні зовнішнього вигляду ЛЗ повинний бути підданий контролю якості на відповідність стандартам ДФ або інший НТД. Для правильного висновку про відповідність зовнішнього вигляду ЛЗ вимогам ДФ необхідно встановити зв'язок між зміною зовнішнього вигляду і фізико-хімічними процесами, які можуть відбуватися під впливом зовнішнього середовища за участі ЛЗ. Важливий показник тотожності - розчинність ЛР, причому у цих випробуваннях визначається не фізико-хімічна константа, а властивість розчинятися в різних розчинниках, яка визначається наближеним способом і виражається в умовних термінах для характеристики ЛЗ (табл.1):
Умовні терміни в ДФ (дуже легко розчиний практично нерозчинний і ін.) характеризують об'єм (в мілілітрах) розчинника, необхідного для розчинення однієї вагової частини (в грамах) ЛР. Препарат вважається тим, що розчинився, якщо в розчині при спостереженні в прохідному світлі не виявляються частинки речовини. хімічний лікарський фармакопейний
Зміна розчинності ЛР в процесі її зберігання може бути пов'язано з появою домішок, тому іноді (якщо у ФС є спеціальна вказівка) такий факт розглядається як свідоцтво зміни ступеня чистоти
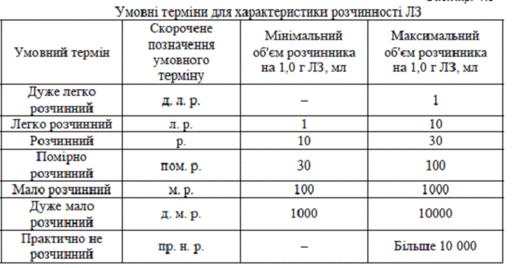
Таблиця 1
Для підтвердження хімічного складу ЛР, що синтезується звичайно проводять елементний аналіз, а для ідентифікації ЛЗ відповідно до вимог ДФ використовують функціональний аналіз.
Хімічні методи встановлення достовірності ЛЗ полягають у ідентифікації за допомогою хімічних реакцій на визначені катіони, аніони, функціональні групи. У фармацевтичній літературі звичайно підкреслюється різний підхід до аналізу неорганічних і органічних ЛР: для неорганічних речовин визначаються катіони і аніони, а органічні речовини аналізуються за функціональними групами, що містяться в них, причому ЛР може містити декілька функціональних груп і давати всі характерні для них реакції.
Для проведення фармакопейного аналізу використовуються:
- * загальні реакції, типові для цілого класу, групи сполук; * специфічні реакції, властиві даній ЛР, які дозволяють
Вирізнити її серед сполук даного класу, групи.
Специфічність реакції характеризується можливістю знайти одні іони у присутності інших. На жаль, специфічних реакцій небагато. Частіше в аналізі ЛР зустрічаються реакції, які називаються селективними (вибірковими), коли реактив утворює різні за зовнішніми ознаками продукти реакції з декількома іонами або функціональними групами, іноді навіть в однакових умовах. Визначення можна здійснити за допомогою реакцій осадження, нейтралізації, термічного розкладу, окисно-відновних реакцій, зміни забарвлення полум'я і ін.
У фармацевтичному аналізі можливість відкриття окремих іонів і функціональних груп визначається наступними показниками:
- * межею виявлення - якнайменшою кількістю аналізованої речовини (в міліграмах або мікрограмах), яку може бути знайдено реактивом в 1 мл розчину за даних умов; * граничним розбавленням - якнайменшою концентрацією розчину, у якому може бути знайдений 1 г даної речовини.
Важливо підкреслити, що при виконанні аналізів необхідно строго дотримуватися методик, вказаних в ДФ і інший НТД, оскільки на чутливість реакції впливають наступні чинники:
- * концентрація речовини; * рН розчину; * температура; * тривалість реакції; * наявність супутніх компонентів; * послідовність додавання розчинів і т. д.
Оскільки велике число ЛЗ містять одні і ті ж іони або функціональні групи, то це дозволило створити уніфіковані методики для ідентифікації за допомогою відповідних реакцій і об'єднати їх в загальну фармакопейную статтю "Загальні реакції на тотожність". Крім того, будь-яка приватна фармстаття містить в розділі "тотожність" одну або декілька реакцій, властивих тільки для даної сполуки.
Фармацевтичний аналіз
До якості лікарських засобів висуваються особливі вимоги, оскільки вони покликані гарантувати ефективність та безпеку препарату, а отже, й здоров'я кожного окремого пацієнта та суспільства в цілому. Важливою складовою забезпечення якості лікарських засобів є фармацевтичний аналіз - сукупність методів, які дозволяють оцінити параметри якості біологічно активних речовин на всіх етапах існування ліків - від розробки та виробництва до реалізації.
Фармацевтичний аналіз має свої особливості, що відрізняють його від інших видів аналітичних досліджень. Ці відмінності пов'язані з великою різноманітністю об'єктів дослідження, оскільки лікарські засоби мають різну природу: вони можуть бути неорганічними, органічними (починаючи з найпростіших аліфатичних речовин до найскладніших макромолекулярних структур), синтетичного та природного походження, можуть являти собою індивідуальні речовини або багатокомпонентні суміші та ін. Широким є також діапазон концентрацій лікарських речовин, що аналізуються. До фармацевтичного аналізу висуваються особливі вимоги, серед яких - правильність, точність, специфічність, чутливість, а також економічність. Серед методів фармацевтичного аналізу можна виділити хімічні, фізичні та фізико-хімічні.
Асортимент лікарських засобів постійно оновлюється. Поява принципово нових наукових концепцій при їх розробці викликає необхідність постійного вдосконалення методів аналізу. В останній час особливо зросло значення інструментальних методів аналізу, що пов'язано з загальним науково-технічним прогресом.
Фармацевтичний аналіз залежно від поставлених завдань включає різні форми контролю якості ліків: фармакопейний аналіз, постадійний контроль у процесі виробництва, аналіз лікарських форм індивідуального виготовлення, експрес-аналіз в умовах аптеки та біофармацевтичний аналіз.
Складовою частиною фармацевтичного аналізу є фармакопейний аналіз.
До якості лікарських засобів висуваються особливі вимоги, оскільки вони покликані гарантувати ефективність та безпеку препарату, а отже, й здоров'я кожного окремого пацієнта та суспільства в цілому. Важливою складовою забезпечення якості лікарських засобів є фармацевтичний аналіз - сукупність методів, які дозволяють оцінити параметри якості біологічно активних речовин на всіх етапах існування ліків - від розробки та виробництва до реалізації.
Фармацевтичний аналіз має свої особливості, що відрізняють його від інших видів аналітичних досліджень. Ці відмінності пов'язані з великою різноманітністю об'єктів дослідження, оскільки лікарські засоби мають різну природу: вони можуть бути неорганічними, органічними (починаючи з найпростіших аліфатичних речовин до найскладніших макромолекулярних структур), синтетичного та природного походження, можуть являти собою індивідуальні речовини або багатокомпонентні суміші та ін. Широким є також діапазон концентрацій лікарських речовин, що аналізуються. До фармацевтичного аналізу висуваються особливі вимоги, серед яких - правильність, точність, специфічність, чутливість, а також економічність. Серед методів фармацевтичного аналізу можна виділити хімічні, фізичні та фізико-хімічні.
Асортимент лікарських засобів постійно оновлюється. Поява принципово нових наукових концепцій при їх розробці викликає необхідність постійного вдосконалення методів аналізу. В останній час особливо зросло значення інструментальних методів аналізу, що пов'язано з загальним науково-технічним прогресом.
Фармацевтичний аналіз залежно від поставлених завдань включає різні форми контролю якості ліків: фармакопейний аналіз, постадійний контроль у процесі виробництва, аналіз лікарських форм індивідуального виготовлення, експрес-аналіз в умовах аптеки та біофармацевтичний аналіз.
|
Досліджувана речовина |
Методика дослідження та реактиви |
Результати реакції |
Хімізм реакції |
|
Органічні сполуки | |||
|
Кислота ацетилсаліцилова |
|
|
|
|
Кислота аскорбінова |
|
|
|
|
Кислота фолієва |
|
|
1. Утворення 6-птеридинкарбонової кислоти . Утворення комплексної сполуки купруму |
|
Кислота нікотинова |
0,005 г досліджуваного порошку розчиняють в 3 краплях води при нагріванні і додають краплю розв. СН 3СООН і краплю розчину (СН 3СОО)2Сu |
Осад блакитного кольору |
Утворення нікотинату купруму |
|
Адреналін гідрохлорид |
|
|
|
|
Етинілестрадіол |
2 мл препарату розчиняють в 2 мл конц. H2SO4 |
Оранжево-червоне забарвлення, через 20 хв жовто-зелена флюоресценція в УФ-світлі |
1. Реакція на стероїдну систему |
|
Анальгін |
1. 0,01-0,02 г порошку розчиняють в 1-2 мл води. До одержаного розчину додають 2-3 краплі хлоридної кислоти 2. 0,1 г анальгіну нагрівають в пробірці з 2 мл розведеної хлоридної кислоти |
|
|
|
Анестезин |
1. 0,01 гдосліджуваного порошку нагрівають в 0,5 мл розчину NaOH і додають 0,1 Н розчин І2 до незникаючого жовтого забарвлення 2. 0,01 гдосліджуваного порошку розчиняють в 0,5 мл води, підкислюють 2 краплями розв. HCl, додають краплю розчину NaNO2 і краплю лужного розчину в-нафтолу |
|
|
|
Антипірин |
|
|
|
|
Атропін сульфат |
Декілька кристаликів речовини змочують у фарфоровій чашці 2 краплями конц. HNO3і випарюють на водяному огрівнику досуха. Далі до залишку додають декілька крапель 0,5 М спиртового розчину КОН і ацетону |
Фіолетове забарвлення |
Утворення солей ізонітрокислот: |
|
Барбітал |
Досліджуваний порошок (в надлишку) розчиняють в 0,1М розчині NaOH, додають 2 краплі розчину Co(NO3)2 |
Бузковий осад, який переходить в синій (відмінність від фенобарбіталу) |
Утворення комплексної солі кобальту: |
|
Бензилпеніциліну натрієва сіль |
Декілька кристаликів речовини поміщають у фарфорову чашку і додають 1 краплю розчину, який вміщує 1 мл 1М розчинуNH2OH*HCl і 0,3 мл 1М розчину NaOHез 3 хв додають до одержаної суміші 1 краплю розчинуCH3COOH, перемішують і додають 1 краплю розчину Cu(NO3)2 |
Зелений осад |
Утворення гідроксамату купруму: |
|
Бромкамфора |
|
|
Zn+2NaOH>Na2ZnO2+H2^ R-Br+ H2+NaOH>R-H+NaBr+H2O NaBr+AgNO3>AgBrv+NaNO3 |
|
Хінін |
|
|
2. Талейохінна проба |
|
Хлоралгідрат |
|
|
|
|
Кофеїн |
0,005 г досліджуваного порошку змішують у фарфоровій чашці з кристаликом KClO3або 2 краплями H2O2. Додають краплю розв. HCl і випарюють досуха |
Жовта пляма, яка переходить в пурпурову від дії парів NH4OH |
Утворення мурексиду Див. нижче: |
|
Мурексидна реакція: | |||
|
Кортизон у ацетат |
|
Забарвлення 3. Оранжево-червоний осад |
|
|
Дезоксикортикостерону ацетат |
2 мг речовини розчиняють в 2 мл конц. H2SO4, додають 1,5 мл води, збовтують, знову додають 1,5 мл води і збовтують |
Вишневе забарвлення, зеленувато-коричнева флуоресценція |
Реакція на стероїдну систему |
|
Діетилсільбестролу пропіонат |
5 мг речовини розчиняють в 2 мл C2H5OH, змішують з 1 мл лужного розчину гідроксиламіну і залишають на 5 хв. Додають 2 мл розв. HCl і краплями 10% розчин FeCl3 |
Темно-вишневе забарвлення |
Утворення гідроксамату феруму: (С 2H5C(O)NHO-)3Fe |
|
Дибазол |
До 0,005-0,01 г речовини або лікарської суміші, яка містить таку саму кількість дибазолу додають 3 краплі 3% спиртового розчину нітрату кобальту. Реакції заважають темі сал, натрію кофеїн-бензоат, барбітал-натрію |
Голубе забарвлення |
Утворення комплексної солі кобальту: |
|
Дикаїн |
До 0,005 г досліджуваного порошку додають краплями конц. HNO3. Реакції заважає фенацетин |
Жовте забарвлення |
Нітрування бензольного кільця: |
|
Димедрол |
До 0,001 0,02 г речовини або лікарської суміші, яка вміщує таку саму кількість димедролу додають 1-2 краплі конц. H2SO4 |
Оранжеве забарвлення |
Утворення оксонієвої солі: |
|
Ефедрину гідрохлорид |
0,01 г досліджуваного порошку розчиняють в 0,5 мл води, додають краплю розчину NaOH, 1 краплю розчину купрум сульфату, 1 мл ефіру та збовтують |
Ефірний шар забарвлюється в фіолетовий колір |
Утворення комплексної солі купруму: |
|
Глюкоза |
На предметне скло наносять краплю розчину AgNO3 і краплями розчин NH4OH до розчинення осаду, що утворився спочатку. Далі додають краплю досліджуваного розчину |
Утворення "срібного дзеркала" |
Реакція на альдегіди: R-CHO+ 2Ag(NH3)2NO3+H2O>RCOONH4+2NH4NO3+2Agv+NH3 |
|
Гліцерин |
|
|
1. KHSO4 дегідратує гліцерин з утворенням акролеїну, який відновлює Hg2+ реактиву Неслера до металічної ртуті: H2C=CH-CHO + K2[HgI4]+3KOH>H2C=CHCOOK+Hgv+4KI+H2O 2. Утворення сполук купруму з гліцерином: |
|
Гексаметилентетрамін |
До 0,01 г досліджуваного порошку додають краплю конц. H2SO4 і нагрівають. Далі додають 0,001 г саліцилату натрію |
Червоне забарвлення |
(CH2)6N4 + 2H2SO4 + 6H2O 6НСНО + 2(NH4)2SO4 |
|
Ізоніазид |
До 0,03 г речовини додають 0,03 г 2,4-динітрохлорбензолу, 2 мл 95 % C2H5OH і кип'ятять 2-3 хв. Після охолодження додають 1 краплю розчину NaOH |
Буро-червоне забарвлення |
Реакція на визначення піридинового циклу |
|
Левоміцетин |
|
|
1. Див. нижче 2. Див. нижче |
| |||
|
Метилтестостерон |
2 мг речовини розчиняють в 2 мл конц. H2SO4. До реакційної суміші додають при збовтуванні 2 рази по 1,5 мл води |
Ясне жовтувато-оранжеве забарвлення. Жовтувато-оранжеве забарвлення, зелена флюоресценція |
Реакція на стероїдну систему. |
|
Нікотинамід |
0,01 г речовини розчиняють в 1 мл розчину NaOH і нагрівають |
Запах амоніаку |
NC5H4-CONH2 + NaOH > NC5H4-COONa +NH3^ |
|
Новокаїн |
|
2. Утворюється осад синього кольору, нерозчинний в CHCl3 і розчинний в ацетоні з утворенням синього забарвлення |
Див. Аміназин |
|
Пахікарпіну гідрохлорид |
До 0,02-0,03 г речовини в пробірці додають декілька крапель конц. H2SO4. Виділяється йод. |
Після додавання хлороформу останній забарвлюється в фіолетовий колір |
Реакція на I- |
|
Папаверину гідрохлорид |
До 0,001 г досліджуваного порошку додають краплю конц. HNO3 і нагрівають. |
Оранжево-золотисте забарвлення | |
|
Резорцин |
|
|
|
|
Рибофлавін |
|
|
|
|
Розчин формальдегіду |
|
|
|
|
Фенобарбітал |
|
|
1. Утворення комплексної солі кобальту: |
|
Фенілсаліцилат |
|
|
1. Реакція на фенольний гідроксил: С 6Н 5ОСОС 6Н 4ОН + FeCl3 = С 6Н 5ОСОС 6Н 4ОFeCl2 + HCl 2. Індофенольна реакція: |
|
Стрептоміцин сульфат |
|
|
|
|
Строфантин |
|
|
|
|
Тетрациклін гідрохлорид |
До 0,05 г речовини додають 2 мл конц. H2SO4, 1 краплю води і 1 краплю розчинуFeCl3 |
Фіолетове забарвлення, яке переходить в темно-жовте і червоно-коричневе |
Утворення солі феруму і продуктів розкладу тетрацикліну |
|
Теофілін |
|
|
|
|
Тіамін гідрохлорид |
0,5 0,2 % розчину речовини змішують з 1 мл розчину NaOH, 2 мл розчину K3[Fe(CN)6] і 5 мл ізоамілового спирту і залишають на деякий час |
Синя флюоресценція в УФ-світлі |
Див. нижче. |
|
Тіохромна реакція: | |||
|
Токоферолу ацетат |
До 0,01 г речовини додають 5 мл абсолютного спирту, 1 мл конц. HNO3 і нагрівають 15 хв при 80єС на водяному нагрівнику |
Червоне забарвлення |
Утворення о-токоферилхінону |
|
Вікасол |
0,1 г речовину розчиняють в 2 мл води і додають 1 мл 1М NaOH |
Жовтий осад |
Утворення 2-метил-1,4-нафтохінону: |
Література
- 1. Мелентьева Г. А., Антонова Л. А. Фармацевтическая химия. - М.: Медицина. - 1985. - 480 с. 2. Мелентьева Г. А., Краснова М. А. Учебное пособие по фармацевтической химии - М.: Медицина. - 1973. - 216 с. 3. Аксютина Н. П., Качан О. Б., Кириченко Л. А., Митченко Ф. А. Методы анализа лекарств. - К.: Здоровье. - 1984. - 237 с. 4. Аксенова З. Н., Андриянова О. П., Арзамасцев А. П. и др. Руководство к лабораторным занятиям по фармацевтической химии. - М.: Медицина. - 1987. - 320 с. 5. Безуглий П. О., Гриценко І. С., Українець І. В. та ін. Фармацевтична хімія. - Вінниця: Нова книга. - 2008. - 554 с. 6. Сенов П. Л. Фармацевтическая химия. - М.: Медицина. - 1978. - 480 с.
Похожие статьи
-
Одним із важливих напрямів розвитку української науки є дослідження у галузі фармації. Провідним центром у цій галузі в Україні був і залишається...
-
У комплексному лікуванні хворих хронічним гломерулонефритом і пієлонефритом, поряд з медикаментозними засобами і повноцінною дієтою, широко...
-
Методи рефлексодіагностики, Аурикулодіагностика - Рефлексотерапія
Для встановлення акупунктурного діагнозу, тобто ступеня функціонального дисбалансу (надлишок, не достаток)- окремих меридіанів, внутрішніх органів чи...
-
Метод сигмальних відхилень: порівнюються результати антропометричних досліджень дитини (довжина та маса його тіла, окружність грудної клітини) з даними...
-
Антидіабетичні властивості лікарських рослин, поширених на території України
Вступ На сьогоднішній день у світі нараховується понад 170 млн хворих на цукровий діабет (ЦД); більше того, передбачається, що у 2025 р. показник...
-
Мікропресорефлексотерапія та вібромасаж. Методи та техніка впливу. - Рефлексотерапія
Мікропресорефлексотерапія (цуботерапія) є способом пролонгованої дії на механорецептори і полягає в накладанні і фіксації в зоні точок акупунктури кульок...
-
Предмет, задачі і методи патологічної фізіології
ПРЕДМЕТ, ЗАДАЧІ І МЕТОДИ ПАТОЛОГІЧНОЇ ФІЗІОЛОГІЇ Патологічна фізіологія - це наука, яка вивчає загальні закономірності виникнення, розвитку і завершення...
-
Неінвазивні методи діагностики атопічного дерматиту у дітей
Мета дослідження - вивчення перспективи і можливості застосування дерматоскопії та ультрасонографії шкіри як методів об'єктивної оцінки стану шкіри при...
-
Встановлено, що хірургічне лікування гриж міжхребцевих дисків поперекового відділу хребта нерідко пов'язане з недостатнім і суб'єктивним прогнозуванням,...
-
Об'єктом проведеного дослідження стали процеси відтворення населення, а саме вплив радіаційного чинника та паління на ризик виникнення репродуктивних...
-
Виявлення дубильних речовин, Виявлення сапонінів - Фармакогностичне вивчення рослин роду хризантема
1. Реакція з розчином залізо-амонійних галунів. До 2 мл витягу додавали 4 краплі розчину залізо-амонійних галунів. Спостереження: чорно-синє забарвлення....
-
Загальна характеристика засобів фізичної реабілітації при хронічному пієлонефриті, гломерулонефриті Серед основних видів не медикаментозних методів...
-
Рослинний матеріал та умови стресу, викликаного важкими металами Рослинний матеріал та умови культивування Дослідження проводились на рослинах Nicotiana...
-
Гіпотермія - зниження температури ділянки (зони) тіла нижче фізіологічної без зміни фазового стану води, тобто охолодження до температури вище 0С....
-
Масаж - Методи загартовування. Масаж
Масаж -- це сукупність прийомів механічної дозованої дії на різні ділянки поверхні тіла людини за допомогою рук або спеціальних апаратів із лікувальною...
-
Методи загартовування - Методи загартовування. Масаж
Загартовування -- це своєрідне тренування термоадаптаційних механізмів організму, їхня підготовка до своєчасної мобілізації, це один із методів...
-
Для визначення ефективності занять лікувальної гімнастики, відпустці процедур лікувального масажу і фізіотерапії на організм хворих на хронічний...
-
У розділі представлена загальна методологія досліджень, яка сприяла досягненню мети відповідно до комплексу теоретичних, інструментальних та серії...
-
Синергічна дія поверхнево активних речовин nocardia vaccinii imb b-7405 і антифунгальних засобів
В статье исследована антифунгальная активность по отношению к грибам родов Candida, Fusarium и Mucor смеси поверхностно-активных веществ (ПАВ) Nocardia...
-
Вихідний розчин. 0.200 г здрібненої на порошок сировини (250) (2. 9. 12) поміщають у круглодонну колбу місткістю 100 мл, додають 40 мл спирту(60 %,...
-
Підсумовуючи наведені дані, відмічаю наступне: ? Досліджувана лікарська рослинна сировина пасифлори інкарнатної містить істинні алкалоїди індольного...
-
Виявлення флавоноїдів - Фармакогностичне вивчення рослин роду хризантема
1. З 10% розчином хлориду феруму (ЇІ) (на фенольні гідроксили). До 1 мл витягу додавали 10 % розчин заліза (III) хлориду. Спостереження : зелене...
-
Солодка голая - Семейство бобовые
Radices Glycyrrhizae - корни солодки Солодка голая - Glycyrrhiza glabra L. Семейство бобовые - Fabaceae Другие названия: - солодка гладкая - лакрица -...
-
Хімічний склад Чорниці - Чорниця звичайна
Плоди чорниці містять вуглеводи (5,3-7,4%): глюкоза, сахароза, фруктоза, мальтоза, арабіноза, галактоза; органічні кислоти (0,90-1,28%): лимонна,...
-
Профілактика отруєнь - Токсикологія сполук ртуті
При отруєннях ртуттю передусім застосовують спеціфічний антидот - унітіол. Можливе застосування ЕДТА, БАЛ, дикатитолу, тіосульфату натрія. Всі ці...
-
Лікування - Токсикологія сполук ртуті
При отруєнні ртутними препаратами, передусім, використовують спецефічний антидот - унітіол. При нейтральній реакції унітіолу у воді безкольорові, при...
-
Моніторинг та прогноз впливу інфраструктур водного транспорту на навколишнє середовище Актуальність проблеми формування систем оперативного контролю за...
-
Національними нормами встановлено, обов'язковість обладнання систем накопичення або очистки всіх видів суднових стічних вод, на суднах з екіпажем більше...
-
Протягом кількох років нами проводилися цілеспрямовані дослідження з проблеми забруднення басейну Чорного моря баластними водами, в тому числі за...
-
Диференційно-діагностичні ознаки анафілактичного шоку і східних станів - Алергічні реакції організму
Ознаки Істинний анафілактичний шок Психопатологія Анафілактоїдні реакції Причини Введення ліків, укус комах, вживання в їжу мінімальної кількості...
-
Окончательная фиксация непрямых реставрационных конструкций на цемент является заключительным клиническим этапом ортопедического лечения, и результат...
-
Сіупінь 0 Зоб відсутній (кожна з часток ЩЗ не перевищує розміру дистальної фаланги великого пальця руки пацієнта) Ступінь І Зоб пальпується, але...
-
Медико-соціальні проблеми наркотизму
МЕДИКО-СОЦІАЛЬНІ ПРОБЛЕМИ НАРКОТИЗМУ Наркотик -- це будь-яка хімічна сполука, що впливає на психічний стан організму. Зловживання наркотиками -- це їхнє...
-
Встановлення тотожності меліси лікарської листя за морфолого-анатомічними ознаками
Вступ Препарати меліси лікарської мають виражені седативні, анксіолітичні, антидепресивні, спазмолітичні, імуномодулюючі, противірусні, антиалергічні та...
-
Це непряме визначення глибини дефекту кислотної ерозії емалі після її протравлення розчином НСL. Крапля 1 ммоль/л НСL наноситься на очищену і висушену...
-
Особливості сенсомоторних реакцій у школярів зі слуховою депривацією
У статті наведено результати дослідження простої і складної зорово-моторних реакцій у школярів різних вікових періодів із нейросенсорною депривацією....
-
Вступ - Алергічні реакції організму
В основі алергічних захворювань лежать зміни реактивності організму у відповідь на потрапляння в організм різних алергенів - речовин, що здатні...
-
Анатомо-фізіологічні особливості сечовивідної системи Система сечовиділення включає в себе двi нирки, сечоводи, сечовий мiхур. Основна їх функцiя -...
-
Актуальність теми: профілактика дитячих інфекційних захворю - вань проводиться шляхом проведення профілактичних щеплень; активна імунізація дитини є...
-
Імуностимулятори - Алергічні реакції організму
Лікарські речовини, які модулюють (стимулюють) неспецифічну резистентність організму. Засоби, які стимулюють (нормалізують) імунні реакції організму,...
Методи ідентифікації лікарських засобів