Самородные минералы углерода. - Биогенные элементы в верхних слоях литосферы
Эта группа представлена двумя резко различными по физическим свойствам полиморфными модификациями углерода: алмазом и графитом.
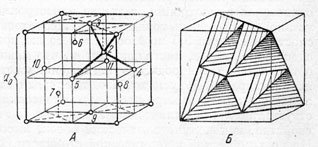
Рис. 1. Кристаллическая решетка алмаза. А - изображение центров атомов; В - та же решетка в виде тетраэдров, вершины и центры которых являются центрами атомов углерода.
Кристаллическая структура алмаза (рис. 1) в целом как бы похожа на структуру гранецентрированного куба, но отличается от нее тем, что атомы углерода располагаются не только на гранях куба, но также в центрах половинного числа малых кубов, чередующихся с пустыми малыми кубами. Обычно представляют, что атомы углерода в кристаллической структуре алмаза соединены друг с другом исключительно ковалентными связями по направлениям, соединяющим центр тетраэдра с его вершинами. Однако Н. В. Белов развил более естественное представление о структуре алмаза, как о структуре типа ZnS с двумя сортами ионов-С4+ и С4- (радиус катиона С4+ составляет около 0,15, а аниона О4--около 1,5Е), что обусловливает плотнейшую упаковку анионов в структуре. С таким представлением хорошо увязываются гемиэдрические черты кристаллов алмаза и ряд таких свойств, как бесцветность, низкая электропроводность, необычайно высокая твердость, весьма высокая устойчивость при широких колебаниях температуры и давления (в частности, при нагреве до температуры 2500° в отсутствии кислорода не обнаруживает никаких изменений), очень высокая устойчивость по отношению к кислотам и щелочам и др.
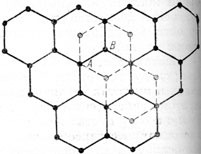
Рис. 3. Расположение центров атомов в листах решетки графита. Каждый следующий лист как бы сдвинут на расстояние в половину диаметра шестерных колец
Структура графита весьма существенно отличается от структуры алмаза Ионы углерода в графите лежат листами, представленными плоскими гексагональными сетками (рис. 3). По Н. В Белову, кристаллическая структура графита представляет плотнейшую упаковку крупных анионов С4, в которой половина треугольников в каждом листе занята маленькими катионами С4+. Каждый ион в плоской сетке окружен тремя соседними ионами на расстоянии 1,42Е (в алмазе 1,54Е), расстояние же между плоскими сетками 3,40Е, т. е. в два раза больше. Отсюда становится понятным ряд свойств графита: его значительно меньший удельный вес по сравнению с алмазом, чрезвычайно легкая расщепляемость на тонкие чешуйки, резко выраженная оптическая анизотропия, а также анизотропия твердости, которую удается установить при очень точных тонких исследованиях (перпендикулярно к плоскости спайности 5,5 по Моосу, а в то же время, благодаря очень слабому сцеплению листов, настолько мягок, что мажет бумагу и пальцы). Этим же объясняется неоднородность поглощения света, чем и обусловлен черный цвет минерала. Допускают, что тип связи атомов в графите, в отличие от алмаза, в какой-то мере носит металлический характер, т. е. в связях участвуют также "металлические" электроны. С этим вполне увязываются такие свойства, как полуметаллический блеск, высокая электропроводность и др. Но по химической и термической стойкости графит все же близок к алмазу.
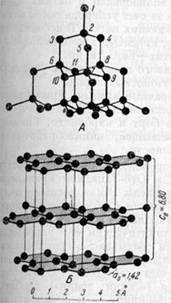
Рис. 4. Расположение центров атомов в алмазе (А), при горизонтальном расположении плоских сеток (111), и в графите (Б)
Если мы решетку алмаза изобразим в таком виде, как это показано на рис. 4-А, т. е. вдоль тройной оси (ср. номера атомов на рис. 1-А), то в горизонтальных плоских сетках также заметим гексагональные кольца (атомы 6,11, 8, 9, 7 и 10), с той лишь разницей, что эти сетки не совсем плоские: три атома располагаются несколько выше по сравнению с другими тремя.
Алмаз - С. Название происходит от греческого слова "адамас" - непреодолимый (очевидно, имелись в виду его наивысшая твердость и устойчивость по отношению к физическим и химическим агентам).
Разновидности:
- - борт - неправильной формы сростки и шаровидные лучистые агрегаты; - карбонадо - тонкозернистые пористые агрегаты, окрашенные аморфным графитом и посторонними примесями в буровато-черный цвет.
Происхождение. Коренные месторождения генетически связаны с ультраосновными глубинными изверженными породами: перидотитами, кимберлитами и др. В этих породах кристаллизация алмаза происходит, очевидно, на больших глубинах в условиях высоких температур и давления. Судя по формам и условиям нахождения, алмаз кристаллизовался в магмах одним из первых. Не ясно, кристаллизовался ли алмаз за счет углерода самой магмы или за счет углерода, усваивавшегося из окружающих пород. В ассоциациях с алмазом наблюдались: графит, оливин - (Mg, Fe)2SiO4, хромшпинелиды - (Fe, Mg)(Cr, Al, Fe)2O4, магнетит - FeFe2O4, гематит - Fe2O3 и др.
Россыпные месторождения алмаза, устойчивого в экзогенных условиях, образуются за счет разрушения и размыва алмазоносных пород.
Графит - С. Название происходит от греческого слова "графо" - пишу. Разновидности:
- - графитит - скрытокристаллическая разность, - шунгит - аморфная разность, образовавшаяся, повидимому, в результате природного коксования углей.
Происхождение. В природе графит образуется при восстановительных процессах в условиях высоких температур.
Встречается иногда среди магматических горных пород разнообразного состава. Источником углерода во многих случаях являются вмещающие углеродсодержащие горные породы.
Известны случаи находок графита в пегматитах. Встречаются месторождения на контактах известняков с изверженными породами в провинциях Онтарио и Квебек в Канаде, а также жильные месторождения крупнолистоватого графита, например на о. Цейлон.
Широко распространены метаморфические месторождения графита, возникшие за счет каменных углей или битуминозных отложений в условиях регионального метаморфизма или под влиянием интрузий магмы.
Трансформация и накопление соединений азота в верхних слоях литосферы.
Вследствие исключительной прочности молекулы N2, почти полностью сосредоточен в атмосфере. Часть газообразного азота растворена в природных водах, которые содержат и растворенные азотсодержащие органические вещества и неорганические ионы: катион аммония, нитрит-ион и нитрат-ион. Поскольку азот не образует нерастворимых солей, он только в редких случаях накапливается в литосфере. Так, в южноамериканской пустыне Атакама есть скопления нитрата натрия, который, несмотря на высокую растворимость в воде, сохраняется благодаря исключительно сухому климату.
Слово "азот" буквально означает "безжизненный", поскольку он не поддерживает дыхание. Однако этот элемент является обязательной составной частью белков. Поэтому азот в значительном количестве содержится в живых организмах и "мертвом" органическом веществе. Азот непрерывно перемещается между атмосферой, океаном, живыми организмами и почвой.
В атмосфере под действием электрических разрядов азот переходит сначала в монооксид азота, а затем в диоксид азота. Влага воздуха и кислород превращают диоксид азота в азотную кислоту
4NO2 + 2H2O + O2 = 4HNO3
Соединения азота легко растворяются в атмосферных осадках и попадают на поверхность Земли.
Большое значение в связывании атмосферного азота имеет жизнедеятельность клубеньковых бактерий, обитающих на корнях бобовых растений. Ферменты этих бактерий превращают молекулярный азот в соединения, которые затем усваиваются растениями. Из растений связанный азот поступает в организмы животных, в основном, в виде аминокислот и белков. После гибели живых организмов органические вещества превращаются в неорганические соединения, снова усваиваемые растениями. Часть азота в почвах превращается в молекулярный азот и переходит в атмосферу. Молекулярный азот образуется также при полном окислении органических веществ.
Соединения азота попадают в атмосферу с выбросами промышленных предприятий и транспорта, а в природные воды - с бытовыми и промышленными отходами.
Слишком большое количество растворимых соединений азота в почве приводит к росту их содержания в продуктах питания и питьевой воде, это может стать причиной серьезных заболеваний. Соединения азота накапливаются в водоемах и вызывают зарастание озер и водохранилищ. Пока подобные явления наблюдаются лишь в отдельных районах, где в окружающую среду попадает много соединений азота. В целом же природа пока справляется с тем количеством связанного азота, которое производится человеком.
Похожие статьи
-
Углерод -- основной строительный элемент живых организмов. Он входит в состав всех органических соединений. Все органическое вещество на земном шаре...
-
Почвы, Биогенные элементы. - Биогенные элементы в верхних слоях литосферы
Почва - поверхностный плодородный слой земной коры, дающий жизнь растениям. Как составная часть биосферы, почва - особое природное образование,...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Литосфера - Биогенные элементы в верхних слоях литосферы
Литосфемра (от греч. лЯипт -- камень и уцбЯсб -- шар, сфера) -- твердая оболочка Земли. Состоит из земной коры и верхней части мантии, до астеносферы,...
-
Углерод (лат. Carboneum), С - химический элемент IV группы периодической системы Менделеева. Известны два стабильных изотопа 12С (98,892 %) и 13С (1,108...
-
Введение, Общая характеристика химического элемента, Физические свойства - Биогенные элементы. Сера
Семра -- элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов Д. И. Менделеева, с атомным номером 16....
-
Нахождение в природе и основные соединения - Биогенные элементы. Сера
Сера химический месторождение Сера довольно широко распространена в природе. В земной коре ее содержание оценивается в 0,05% по массе. В природе часто...
-
Химические свойства - Биогенные элементы. Сера
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в...
-
Источники поступления в живой организм Суточную потребность в сере можно обеспечить правильно организованным рациональным питанием. Основными источниками...
-
Физико-химические свойства хрома - Хром. Элемент периодической системы химических элементов
Хром является серебристо-белым, твердым, блестящим, но в то же время довольно хрупким металлом. Ранее считалось, что хром практически не обладает...
-
Алмаз - графит Алмаз. При слове "алмаз" сразу же вспоминаются окутанные завести тайны истории, повествующие о поисках сокровищ. Когда-то люди,...
-
Определение биогенных элементов в природных водах
Биогенными элементами (биогенами) традиционно считаются элементы, входящие, в значительных количествах, в состав живых организмов. Круг элементов,...
-
Магнийорганические соединения. - Химический элемент Магний
Соединения магния с органическими кислотами. Ацетат магния Mg(CH3COO)2 - хорошо растворимое в воде соединение. Оксалат магния MgC2O4 - труднорастворимое...
-
Круговорот углерода связан с использованием СО при фотосинтезе; в процессе дыхания растение возвращает СО в атмосферу. Животные, поедая растения,...
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
По характеру химической связи кристаллы делятся на 4 группы: молекулярные, ковалентные, ионные и металлические. В соответствии с этой классификацией...
-
В зависимости от направления перекрывания атомных орбиталей различают два вида ковалентной связи: -связь возникает при перекрывании атомных орбиталей...
-
ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
В соответствии с электронной конфигурацией атома 4d105s255p1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом...
-
Водород, Углерод - Химия в строительстве
Водород (Н) - это бесцветный газ без запаха. Водород - самое легкое вещество среди химических элементов. Смесь водорода и кислорода в пропорции 2:1 очень...
-
Гибридизация атомных орбиталей углерода - Типы связей в органической химии
Атомная орбиталь - это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако - это...
-
Теллур - Химия элементов VI группы
Теллур -- химический элемент 16-й группы, 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium) . Атом...
-
Брожение - окислительно-восстановительный процесс, приводящий к образованию АТФ, котором окислителем и восстановителем служат органические соединения,...
-
Алюминий - химически активный металл, но прочная оксидная пленка определяет его стойкость при обычных условиях. Практически во всех химических реакциях...
-
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 путем разложения оксида ртути в герметично закрытом...
-
Висмут -- редкий элемент - Висмут
Это утверждение может показаться странным, особенно после упоминания о 70 минералах элемента № 83. Тем не менее, содержание висмута в земной коре...
-
Правила определения степени окисления элемента - Окислительно-восстановительные процессы
Степень окисления - это условный заряд, который приписывается атому При допущении, что все связи в веществе являются Ионными. Известно, что чисто ионной...
-
Это самый распространенный вариант. В реакции твердое+твердое, твердое+жидкость или твердое+газ продукт образуется на поверхности раздела фаз, и если он...
-
Йенс Якоб Берцелиус - Становление понятия о химическом элементе
Особенно большое значение имели работы шведского химика Берцелиуса, который дал более точные определения атомных масс. Уже до Берцелиуса Дальтон...
-
ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. - Галлий
Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ножом) металл превратился в...
-
, Основные минералы алюминия - Геохимическая характеристика алюминия
Основные минералы алюминия Геохимические свойства алюминия обусловлены характером строения электронной оболочки его атома, легко теряющего валентные...
-
Хлор - Седьмая группа элементов периодической системы
Хлор (лат. Chlorum), Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453; относится к семейству...
-
Периодическая система элементов - Химия в строительстве
Ученые давно обратили внимание на тот факт, что если исследовать свойства элементов в порядке их атомных зарядов, то окажется, что почти одинаковые...
-
Реакция окисления углерода - Основы теории окислительной плавки
Основная составляющая шихты при выплавке стали - чугун - содержит в среднем 4%. В готовой стали содержание углерода в большинстве случаев исчисляется...
-
Минералы железа - Железо в деятельности человека
В земной коре железо распространено достаточно широко -- на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди...
-
Кристаллическая решетка. Координационное число Кристаллы - Твердые тела, обладающие трехмерной периодической структурой, которая называется...
-
Ван-дер-Ваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия Молекула - Химически...
-
Еще в начале 20 века было установлено, что при взаимодействии СО и Н2 в присутствии соответствующих катализаторов можно получить углеводороды. Так, в...
-
Данные для расчета: Основная реакция: (1) Побочные реакции: Рабочий объем катализатора - 24 м3. Расход оксида углерода и метанола на побочные продукты с...
-
Таблица 2 - Структура сырья в производстве метанола, %. Сырье В мире Беларусь и Россия Природный газ 73,8 70,7 Нефть и нефтепродукты 24,4 4,0 Отходы...
-
Соединение Магния., Неорганические соединения магния. - Химический элемент Магний
Для аналитической химии магния имеют значение его труднорастворимые и особенно внутрикомплексные (бесцветные, окрашенные или флуорисцирующие) соединения....
Самородные минералы углерода. - Биогенные элементы в верхних слоях литосферы