Биокерамические материалы - История создания и развития биоматериалов
1.3.3.1 Биокерамические материалы на основе фосфатов кальция
В качестве альтернативы ауто и аллотранспантатам для замещения дефектов костной ткани в настоящее время широко применяется биокерамика.
Биокерамикой называют биоматериалы, имеющие керамическую природу и отвечающие всем требованиям к современным имплантатам.
Первая попытка использовать биокерамику из ортофосфатов кальция (это был тетракальцийфосфат) в качестве материала для лечения искусственно созданных дефектов костей у кроликов была предпринята в 1920 г. Научное обоснование применения современной керамики было дано в 50-е годы прошлого столетия и заключалось в том, что некоторые виды керамики могут обладать способностью остоеоинтеграции с подлежащей костью во время функциональной нагрузки.
Дополнительный интерес вызывала возможность использования керамических материалов для изготовления имплантатов в качестве протеза кости, причем пористые керамические материалы обладали определенными преимуществами перед другими материалами.
Изначально было признано, что биокерамика может быть изготовлена в
Широком диапазоне композитных субстанций и форм, и в зависимости от необходимости может использоваться как биотолерантный, биоактивный или биодеградирующий материал. На сегодняшний день эта концепция реализована на практике, благодаря чему из биокерамики изготавливают материалы для эндопротезов в травматологии и ортопедии, имплантаты в челюстно-лицевой хирургии, материалы для замещения костных дефектов, пматериалы в стоматологии, которые нашли широкое применение в клинической практике. Биокерамика может содержать в себе такие вещества как фосфат или сульфат кальция, углерод, кремний и другие вещества.
Современная биокерамика включает в себя вещества естественного
Происхождения, преимущественно в композитном составе, которые могут использоваться как наполнители, средства депонирования лекарственных препаратов, дополнения к костным трансплантатам, а так же остеозамещающие материалы, обеспечивающие управляемое воздействие на репаративный остеогенез.
Биокерамические материалы можно разделить по типу биохимического взаимодействия с организмом.
Первый тип - биоинертные (биотолерантные), к которому относятся биоматериалы, такие как оксид алюминия и оксид циркония, которые сохраняют форму имплантата и поверхностную структуру без врастания тканей и не изменяются под действием окружающей среды.
Второй тип - биологически активные материалы, изменяющиеся на
Границе с живыми тканями типа гидроксиапатита.
Третий тип - биорезорбируемые материалы, полностью заменяющиеся биологическими структурами, типа трикальцийфосфата или сульфата кальция.
Биоинертная биокерамика заняла свою нишу в эндопротезировании.
Материалы в этой области должны обладать определенными химическими свойствами (отсутствие нежелательных химических реакций с тканями и межтканевыми жидкостями, отсутствие коррозии) и механическими характеристиками.
Биоинертные керамические материалы, такие как Al2O3 и ZrO2, являются наиболее распространенными материалами для изготовленият эндопротезов крупных суставов, фиксация которых в кости осуществляется путемцементирования или впрессовывания (механическая фиксация). Такие имплантаты могут иметь поры с диаметром более 100 мкм, может происходить врастание кости, что обеспечиваете ее крепление к материалу (биологическая фиксация).
Однако идеальные в теории, эти устройства оказались малоустойчивы к переломам на фоне изменяющихся нагрузок. Производители отказались от изготовления полностью керамических имплантатов.
Большинство биокерамических материалов для производства эндопротезов имеют модуль упругости больше, чем у натуральной кости. К ним относят оксид алюминия и оксид циркония.
Высокую твердость и износостойкость демонстрируют оксид алюминия и оксид циркония, при этом обладая относительно низкой плотностью по сравнению с металлами. Эти материалы так же химически и биохимически инертны. По цвету биокерамические материалы близки к кости, за исключением материалов на основе углерода и композитных субстанций, содержащих оксид хрома.
Новым направлением в производстве биокерамики для эндопротезирования в настоящее время является использование так называемого укрепленного цирконием алюминия.
Комбинация этих двух материалов обеспечивает достижение высокой прочности двуокиси циркония и теромостабильности двуокиси алюминия, за счет чего удалось увеличить твердость и прочность на разрыв. Таким образом, современная керамика в эндопротезировании представляет собой композитный материал, содержащий примеси других оксидов, главным образом оксида циркония, что позволяет еще более улучшить прочностные и трибологические свойства материала.
Однако исследования по использованию имплантатов из керамики позволили сделать вывод об их излишней твердости, отсутствии обратной деформации, низкой механической прочности, склонности к образованию трещин, что может приводить к резорбции подлежащей костной ткани.
При использовании биоинертной керамики вкачестве заместителя костной ткани стабилизирующий эффект сохраняется в течение 3-4 месяцев, в дальнейшем из-за резорбции костной ткани может сформироваться неоартроз. Если площадь имплантата составляет более 25% от общей площади окружающей его костной ткани, то в ней развиваются дистрофические и деструктивные процессы, приводящие к образованию костных полостей.
Биоинертные керамические имплантаты не могут быть сформированы во время операции, то есть они могут быть разработаны в различных формах в ограниченном объеме. Данные обстоятельства не позволяют использовать биоинертные керамические материалы повсеместно при замещении дефектов костной ткани. Тем не менее, подобные материалы, по-видимому, не имеют пока альтернативы в качестве материала для производства компонентов эндопротезов крупных суставов.
В настоящее время существенная часть исследований посвящена оптимизации использования биоинертной и биологически активной керамики для замещения дефектов или в качестве опорных блоков при различной костной патологии. Несомненно, большой интерес вызывает возможность остеоинтеграции биокерамических материалов в макроструктурированную или пористую поверхность за счет врастания кости.
Такие изделия хорошо известны, хорошо изучены их остеокондуктивные свойства, однако их прочностные свойства в условиях разнонаправленной динамической нагрузки вызывают сомнения. Тем не менее, биологически активная биокерамика заняла свою нишу в качестве заместительного материала при пластике костных дефектов в виде монолитных блоков, а так же в виде гранулированной массы или смеси с костными трансплантатами.
Важнейшим свойством биокерамики является частичный остеоиндуктивный эффект, который реализуется за счет способности адсорбировать морфогенетический белок кости. При этом наблюдается отложение остеоида вокруг биокерамических гранул на первом этапе остеорегенерации.
Скорость образования остеоида прямо пропорциональна скорости резорбции биокерамики. Для придания заданных терапевтических свойств, например, депонирования лекарственных препаратов, наиболее часто используется биокерамика на основе сульфатов и фосфатов кальция, реже используется алюминат кальция.
Биоактивные керамические материалы различаются по скорости резорбции и последующему ремоделированию. К настоящему времени установлено, что увеличение удельной поверхности и пористости биокерамики положительно влияет на кинетику образования кости и, следовательно, улучшает биоактивность материала, позволяющий создавать прочный непосредственный контакт с живой костью.
Для понимания взаимосвязи между структурой и биоактивностью, а также с целью конструирования более качественных имплантатов очень важным является точный контроль общей пористости, размера пор, а также внутреннего пористого строения биокерамики.
Некоторые формы биокерамики, такие как костные цементы, обладают опорной функцией, однако прочностные показатели не позволяют их использовать в качестве фиксации компонентов эндопротезов. Во всем мире проводится множество исследований, направленных на изучение возможности придания биокерамическим материалам остеоиндуктивных свойств.
Наиболее часто в этом направлении изучаются материалы на основе сульфата кальция, трикальцийфосфата кальция и гидроксиапатита. С этими материалами составляют композиты посредством добавления аутокости, коллагена или костного морфологического белка (BMP).
Биологически активные кальцийфосфатные материалы (КФМ) на основегидроксиапатита (ГАП) и трикальцийфосфата (ТКФ) являются структурными аналогами минерального компонента костного вещества в силу сходства их химического состава с составом костной ткани. Эти материалы разрабатывались для того, чтобы уменьшить потребность в аутотрансплантатах или в последующем даже заменить их. Основные виды фосфатов кальция приведены в таблице 3.
Таблица 3
Основные виды фосфатов кальция.

Отделенные чертой в нижней части таблицы фосфаты кальция не существуют в водных растворах. Вместе с тем, чистые ГАП и ТКФ не имеют выраженных остеоиндуктивных свойств, низкая рентгеноконтрастность материалов не позволяет проследить процесс их перестройки. Установлено, что кристаллы синтетического ГАП и ТКФ в иологической системе поддаются влиянию метаболизма клеток организма и распадаются на ионы кальция и фосфора, которые в дальнейшем входят в структуру регенерирующей костной ткани.
Гидроксиапатит (ГАП) (Рис. 9) часто используется материалом в изготовлении биокомпозитных материалов для костной пластики в силу своей высокой биосовместимости.
Однако, к сожалению, не удается получить керамику с необходимой прочностью на основе чистого ГАП, что существенно ограничивает область ее применения. Керамика на основе ГАП характеризуется довольно низкой стойкостью к распространению трещин и большим разбросом экспериментальных значений прочности от образца к образцу. Низкая растворимость синтетического ГАП оборачивается его невысокой биоактивностью: костные клетки медленно "переваривают" предложенный им источник кальция и фосфора; как следствие кость медленно врастает в керамический имплантат. По этой причине ведется интенсивный поиск новых композиционных материалов с улучшенными механическими характеристиками.
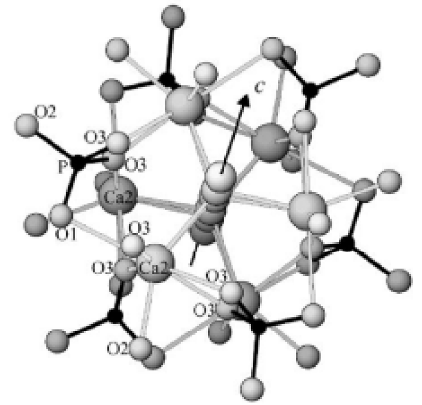
Рис. 9 Координационное окружение ионов кальция в структуре гидроксиапатита.
Для повышения биоактивности ГАП разбавляют более растворимыми фосфатами кальция, например трехзамещенным ортофосфатом, или же изготавливают пористую ГАП-керамику. Пористая поверхность биокерамики обеспечивает большую поверхность соприкосновения между биоматериалом и растущей костью, что приводит к образованию большего количества химических связей. Установлено, что пористый ГАП может заселяться костной тканью. Поэтому биокерамику стараются делать макропористой (размер пор более 100 мкм) путем добавления порообразователей, являющихся либо летучими, либо легко растворимыми соединениями (например, нафталин, сахароза, NaHCO3, NaCl, желатин, микрошарики из полиметилметакрилата). Поскольку увеличение размера макропор биокерамики (были исследованы образцы с порами 150, 260, 510 и 1220 мкм) не привело к улучшению приживаемости имплантатов, нет особой необходимости производить биокерамику с очень большими порами.
Кроме макропор, в любой керамике имеются и микропоры (размер пор менее 10 мкм), которые образуются при спекании порошков. Костная ткань прорастает в поры имплантата, однако наличие крупных пор заметно ухудшает его прочность.
Предложены различные методы синтеза пористой ГАП-керамики. При наиболее оригинальном методе иcпользуют готовый остов из СаСО3, особенности структуры которого наследует получаемая ГАП-керамика. С этой целью применяют такой природный материал, как коралл - основное вещество скелета СаСО3, который при длительном нагревании в растворе гидрофосфата аммония в автоклаве переходит в ГАП, сохраняя исходную пористую структуру коралла. Основной отличительной особенностью ГАП и ТКФ является скорость резорбции, которая меньше у ГАП. Вследствие этого он имеет меньшую остеогенную потенцию и чаще служит основой, на которой происходит процесс образования собственных костных структур. Несмотря на то, что биоактивные керамические материалы на основе фосфатов кальция принято считать остеокондуктивными, проводились исследования, которые показали, что кальцийфосфатные костнопластические материалы обладают остеоиндуктивными свойствами.
Прежде всего, эти свойства зависят от структуры фосфата кальция, которая в оптимальном виде должна сочетать себе пористость на макро - и микроуровнях, в результате такого строения пористой системы обеспечивается образование лакун с остеоцитами без признаков патологической кальцификации. При анализе формирования прямых связей костной ткани, окружающей гидроксиапатитовый блок, было установлено проявление активности остеобластов вне реципиентного ложа, приводящей к образованию частично минерализованной остеоидной ткани. Благодаря этому в последнее время в эндопротезировании стали применять имплантаты с ГАП - покрытием, способными индуцировать остеогенез в зонах отсутствия контакта с эндоостом бедренной кости.
Для получения остеоиндуктивных свойств ГАП - керамики создаются специальные композитные материалы, представляющие комбинацию остеокондуктивного матрикса с биоактивными агентами. В качестве активаторов остеогенеза могут выступать экстракты костного мозга (факторы роста и стволовые клетки) и дексаметазон. Добиться эктопического роста костной ткани возможнопористая кальций фосфатная керамика может поддерживать клеточную дифференциацию, но без стволовых клеток костного мозга остеогенными свойствами не обладает. В ряде случаев имплантаты на основе ГАП могут сами быть причиной осложнений и нагноений.
Наибольший интерес для практического хирурга представляют биорезорбируемые материалы синтетического происхождения, такие как материалы на основе фосфата кальция, в-трикальций фосфата (в-ТКФ) и кальций - дефицитный гидроксиапатит (КДГАП). Такие материалы производят в виде керамики или цементов. В то же время, свойства этих материалов могут отличаться между собой в зависимости от процедуры создания материала - керамика (спекание) и цемент (осаждение).
После перемешивания в виде порошка кальцийфосфатные материалы могут быть применены непосредственно в виде пасты, которая затем помещается непосредственно в дефект костной ткани. В поисках биодрезорбируемых материалов кальцийфосфатные материалы занимают одно из лидирующих мест и становятся все более популярными. В дополнение к биорезорбируемым свойствам этих материалов посредством остеокластической резорбции, а так же высокой биосовместимости, кальцийфосфатные материалы более специфичны для кости, составляя, таким образом, альтернативу керамическим имплантатам, используемых до настоящего времени.
При проведении реконструктивных операций важно учитывать скорость биодеградации материала имплантата. Очень быстрая резорбция может опередить процессы остеогенеза. В таком случае в области имплантата наблюдаются обширные участки фиброзной ткани. Керамика на основе ГАП подвергается биорезорбции медленнее, чем ТКФ. Существуют комбинированные биорезорбируемые материалы, в состав которых входит ГАП и ТКФ. Преимуществом данного вида материала является совмещение твердости ГАП и возможности формирования депо кальция (за счет биодеградации ТКФ).
Благодаря изменению соотношения ТКФ и ГАП в материале можно регулировать скорость биорезорбции имплантационного материала. Важной особенностью кальцийфосфатных материалов является возможность использования их в виде гранул. Это позволяет увеличить площадь поверхности материала, давая возможность использовать их в качестве депо лекарственных средств, что, в свою очередь, вызывает больший интерес к данному виду остеозамещающих материалов. В зарубежной литературе опубликовано мало данных о использовании КФМ в виде гранул для замещения обширных дефектов, и еще меньше данных о использовании таких материалов для замещения костного дефекта с асептически склерозированной стенкой. В естественных условиях скорость резорбции пористых гранул может быть гораздо больше, чем в плотных или призматических блоках, изготовленных из того же материала.
Было оценено формирование кости и резорбция имплантата на основе TКФ - керамического имплантата. Использовалось три вида ТКФ - материала с различной пористостью в гранулированной форме в стандартизованном костном дефекте большеберцовой кости у кроликов. Было показано, что все три вида материала обладали остеокондуктивными свойствами и поддерживали образование новой костной ткани при резорбции имплантата. Образцы с наибольшей пористостью (90%) и самым большим размером пор (1-1000 мкм) биорезорбировались быстрее, чем другие материалы (пористость 75%, размерами пор 100-400 мкм). Таким образом, пористость имплантата и структура пор, по-видимому, играют важную роль в естественных условиях резорбции и врастании новообразованной костной ткани в имплантат. Взаимосвязь между порами также имеют важное значение для интеграции новообразованной костной ткани в материал. Можно предположить, что гранулы кальцийфосфатных материалов имеют решающее преимущество по сравнению иными остеозамещающими материалами, так как благодаря их высокой удельной поверхности биологическая активность более выражена. Помимо этого, гранульные формы имеют большой потенциал в качестве носителей лекарственных средств.
Таким образом, некоторые экспериментальные и клинические исследования показали, что кальцийфосфатные костнопластические материалы в виде гранул для замещения сложных по форме костных дефектов более предпочтительны.
Одним из перспективных направлений является создание композитных материалов на основе бифазной керамики с использованием разных связующих компонентов, таких как белки коллагена с многоуровневой структурной организацией компонентов, биологически активных веществ, стволовых клеток. Исследования показали, что использование таких многокомпонентных имплантатов позволяет приблизиться к структуре и свойствам тех или иных видов костной ткани.
В одном из исследований по изучению репаративных свойств кальцийфосфатных материалов, обогащенных низкомолекулярными неколлагеновыми белками, был проведен сравнительный анализ морфологической картины и элементного состава новообразованной костной ткани, формирующейся в искусственно созданных дефектах в проксимальных эпифизах большеберцовой кости кроликов. Дефекты костной ткани заполняли кальцийфосфатным соединением, содержащим низкомолекулярные неколлогеновые костные белки, имеющие различное сродство к ионообменникам.
Установлено, что формирование регенерата в дефекте происходило отпериферии к центру, а его элементный состав зависел от степени зрелости новообразованной костной ткани. Применение имплантационного материала, содержащего неколлагеновые костные белки, имеющие различное сродство к ионообменникам, показало отсутствие существенных изменений в содержании анализируемых элементов в костной ткани, окружающий дефект. Однако на начальных сроках эксперимента биорезорбция кальцийфосфатных материалов, содержащих низкомолекулярные неколлогеновые костные белки, имеющие сродство к катионообменникам, с последующим замещением дефекта костной ткани происходило быстрее по сравнению с группой, в которой костнопластический материал не имел сродство к ионообменникам.
Таким образом, на основе результатов экспериментальных и клинических исследований можно сделать вывод, что остеотропные материалы на основе ГАП и ТКФ по многим характеристикам превалируют над свойствами алло и ксеноматериалов, что позволяет достичь позитивных результатов при остеопластике костных дефектов. Вместе с тем, ГАП и ТКФ не полностью отвечают требованиям клиницистов из-за отсутствия выраженных остеоиндуктивных свойств, а низкая рентгеноконтрастность материала не позволяет четко проследить процесс его ремоделирования. Для направленной регенерации костной ткани необходимо создать исходные условия для упорядоченной пролиферации остеогенных клеток и капилляров в заданном пространстве.
Обязательными условиями при этом является присутствие биологически активных веществ, которые обеспечивали бы остеоиндукцию остеопластического материала для образования матрицы, на которой будет формироваться костная ткань. Кальцийфосфатные материалы имеют хорошие биосовместимые свойства по тестам проверки биоматериалов на токсичность, гиперчувствительность и канцерогенность. В значительной степени это обусловлено тем, что элементный состав КФМ является естественным для организма. Совокупность свойств делает КФМ перспективным классом материалов для использования в травматологии и ортопедии, а также реконструктивной хирургии.
1.3.3.2 Костные цементы на основе фосфатов кальция
Костные кальцийфосфатные цементы (КФЦ) -- продукты, образующиеся при смешивании порошков фосфатов кальция с водой или затворяющей жидкостью и приобретающие пастообразную консистенцию с последующим переходом в твердое состояние. КФЦ отличаются от традиционно используемых остеопластических материалов (керамические гранулы и блоки) тем, что являются пастообразующими и быстро затвердевают. Впервые идея использования и получения КФЦ была предложена W. Brown и L. Chow в 1983 г. КФЦ подразделяют на апатитовые и брушитовые. Апатитовые цементы получают, смешивая реагенты порошков с затворяющей жидкостью; в результате реакции получается карбонат-апатит или гидроксиапатит (ГАП) с различными примесями. Вначале они активно резорбируются, но затем этот процесс замедляется, и апатитовый цемент может оставаться в стабильном состоянии более 12 мес. Апатитовые цементы превосходят брушитовые по прочности, однако брушитовые обладают более высокой кинетикой резорбции. Был получен брушитовый цемент, с помощью использования порошка в-трикальцийфосфата (в-ТКФ) и монокальция фосфата моногидрата (МКФМ).
В дальнейшем были разработаны инъекционные брушитовые цементы. КФЦ, нашли широкое применение в костно-пластической хирургии и имплантологии, травматологии и в других областях медицины.
Разработаны цементы, способные замещать сложные по форме дефекты в нейрохирургии. Такие материалы разработаны специально для краниопластики и вертебропластики. Костные цементы на основе фосфатов кальция активно используются хирургами в травматологии при лечении переломов различных локализаций в комбинации с остеосинтезом. Несомненным преимуществом КФЦ является способность переноса лекарственных веществ. Данное направление пользуется все большей популярностью.
КФЦ обладают следующими преимуществами перед керамическимиматериалами:
- - обладая нанокристаллической структурой, имеют очень большую удельную площадь поверхности -- до 100 м2/г, тогда как у керамических, гранул она не превышает 1 м2/г; - ? КФЦ делают возможным синтез гранул и блоков при комнатной температуре; - текучесть способствует введению цемента при помощи малоинвазивных хирургических техник, менее агрессивных, чем традиционные оперативные методы; - ? идеальное прилегание к поверхности нанесения дает хороший контакт между костью и цементом даже в геометрически сложных местах повреждений; - поскольку реакция затвердевания, которая протекает в естественныхусловиях, представляет собой растворение и выделение вещества в виде твердого осадка, в большинстве случаев продуктом реакции является ГАП с высокой микропористостью и по структуре сходный с природными апатитами, благодаря чему КФЦ обладают большей реакционной способностью, чем кальцийфосфатная биокерамика; - ? затвердевание КФЦ при комнатной температуре позволяет добавлять в смесь различные лекарственные вещества: от антибиотиков и противовоспалительных средств до факторов роста (костных морфогенетических белков), это свойство наделяет КФЦ большим потенциалом в области контролируемой доставки лекарственных веществ к месту дефекта костной ткани
Однако наряду с преимуществами, КФЦ имеют ряд недостатков, к которым можно отнести слабую механическую прочность, особенно у брушитовых цементов; обязательное давление при перемешивании, что, в свою очередь, вносит ряд ограничений по применению данных цементов. Несмотря на это, данный вид биорезорбируемых материалов представляет, несомненно, большой интерес исследователей.
1.3.3.3 Материалы на основе сульфата кальция
Сульфат кальция - синтетический материал для восстановления костной ткани с длинной историей безопасного применения в медицине, которая насчитывает более 110 лет. В 1892 году H. Dreesmann впервые использовал сульфат кальция для заполнения костных полостей, вызванных туберкулезом. С медицинской точки зрения, сульфат кальция - это материал, обладающий высокой биосовместимостью и остеокондуктивными свойствами. Данные наблюдений подтверждают положительные свойства сульфата кальция в регенерации костной ткани, благодаря пластичности и полной резорбции с последующим ремоделированием и формированием новой костной ткани. В экспериментах подтверждено, что сульфат кальция стимулирует остеогенез при условии непосредственного контакта с костью или надкостницей. В дальнейшем было установлено, что остеогенез возможен в результате взаимодействия материла с подлежащей, хорошо кровоснобжаемой костью или надкостницей, после чего происходит замещение материала новообразованной костной тканью.
Благодаря этим свойствам материалы на основе сульфатов кальция пользуются популярностью среди хирургов.
Похожие статьи
-
Введение - История создания и развития биоматериалов
Актуальность темы исследования . Основная черта нового тысячелетия - возрастающий интерес к повышению качества и увеличению продолжительности...
-
Классификация имплантируемых веществ - История создания и развития биоматериалов
Имплантируемые вещества могут иметь органическое или неорганическое происхождение. К имплантируемым веществам неорганического происхождения относятся...
-
Биоматериалы, Этапы становления биоматериалов - История создания и развития биоматериалов
Этапы становления биоматериалов По мере развития технологий и науки, происходило развитие и биоматериалов, и способы их использования. Биоматериалами...
-
Свойства биоматериалов - История создания и развития биоматериалов
Высокие достижения в медицине и инженерных науках сделали возможным применение искусственных материалов (биоматериалов) в наших телах. Биоматериалы - это...
-
Структура и свойства биологической костной ткани Знание физических, химических, и механических свойств твердых тканей весьма важно, так как определяет...
-
История применения активных металлов для связывания газов внутри вакуумного прибора насчитывает более 100 лет. Для этой цели впервые был использован...
-
Попытки автоматического распознавания предпринимались, начиная с 30-х годов XX века, однако первый OCR-аппарат от американской компании Intelligent...
-
Основную часть сортамента нераспыляемых газопоглотителей как отечественного, так и зарубежного производства составляют высокотемпературные...
-
Введение - История развития метрологии в России
Метроломгия (от греч. мЭфспн -- мера, измерительный инструмент) -- наука об измерениях, методах и средствах обеспечения их единства и способах достижения...
-
Письмовники - сборники образцов документов - История развития секретарского дела
Подводя итог, стоит отметить, что должность секретаря в царской России на всех уровнях классной и должностной иерархии ценилась достаточно высоко и была...
-
Основными параметрами, характеризующими нераспыляемый газопоглотитель, являются следующие: - скорость сорбции; - емкость сорбции; - селективность...
-
Цель курсовой работы - выявить в чем преимущества электроэрозионной обработки от других видов обработок, так же понять ее принцип и узнать о...
-
Таким образом, в данной дипломной работе была изучена научно-техническая литература по созданию порошкового активного материала, с пониженной...
-
Введение, История создания пылесоса - Пылесосы
Пылесос -- устройство, которое создает разрежение воздуха с помощью воздушного Насоса , что позволяет ему всасывать пыль и грязь; пыль собирается...
-
Сварочные электроды Металлические электроды для сварки представляют собой пруток из специальной проволоки, называемой стержнем электрода (в подавляющем...
-
Влияние дендизма на развитие сорочки - История мужской сорочки
Развившийся в начале 19 века в Англии, а затем распространившийся на всю Европу стиль денди - скромного, но элегантно одетого мужчины, образцом которого...
-
Выше отмечалось, что класс нераспыляемых газопоглотителей отличается большим разнообразием. В связи с этим представляется целесообразным провести их...
-
Этапы развития стеклоделия. - История стекла
Естественное стекло известно человеку с древнейших времен. Наконечники стрел, ножи и т. п., изготовленные первобытным человеком из природного...
-
Кожи для низа обуви, Искусственные и синтетические обувные материалы - Кожевенное сырье
Кожи для низа обуви получают преимущественно из шкур крупного рогатого скота и в меньшем количестве -- из свиных шкур и конских хазов (участков шкур,...
-
Конструкционные материалы - Металлические сплавы как основа конструкционных материалов
Конструкционные материалы, материалы, из которых изготовляются детали конструкций (машин и сооружений), воспринимающих силовую нагрузку. Определяющими...
-
Эффективность применения нераспыляемого газопоглотителя во многом зависит от структуры его активного материала. Известно, что у пористых тел истинная...
-
Этапы развития секретарской службы при Екатерине 2. - История развития секретарского дела
У императрицы Екатерины 2 было много доверенных лиц в качестве кабинет-секретарей: Безбородко, Елагин, Теплов. Все эти были люди одаренные: кроме...
-
Основными промышленными методами получения порошков на основе титана и циркония являются следующие: А) метод металлотермического восстановления; Б)...
-
По механизму взаимодействия с активными материалами пористых газопоглотителей газы можно разделить на три группы [2, 3]. Первая группа включает в себя...
-
Цель данного исследования заключалась в определении гранулометрических параметров (фракционного состава и насыпной плотности) порошка титан-ванадиевого...
-
История развития электропривода - Электрооборудование механизма подъема мостового крана
Появление ЭП обусловлено трудами многих отечественных и зарубежных ученых-электротехников. В этом блистательном ряду имена таких крупных ученых как...
-
Цель данного исследования состояла в изучении структуры и формы частиц титан-ванадиевого сплава, а также в определении наличия и состава примесей в этом...
-
История развития ОАО "Малмыжский завод по ремонту дизельных двигателей" В 1931 году на берегу реки Шошма г. Малмыжа, на юге Кировской области, были...
-
Зарождение метрологии в России - История развития метрологии в России
Первые сведения о стандартизации в России относятся к 1555 году; при Иване Грозном специальным указом были установлены постоянные размеры пушечных ядер и...
-
История развития метрологии за рубежом - История развития метрологии в России
Во второй половине XIX века работы по стандартизации проводились почти на всех промышленных предприятиях. Благодаря внутризаводской стандартизации...
-
Исторически доказано, что родиной макаронных изделий является Италия. Макароны (итал. Maccheroni) -- трубчатые макаронные изделия (тесто), из высушенного...
-
Виды известняка по происхождению - Разработка технологии получения строительного материала
Чистые известняки - белого или светло-серого цвета, примеси органических веществ окрашивают карбонат кальция в черный и темно-серый цвета, а окислы...
-
Анализ конструкции (объекта дипломного проектирования) на предмет снижения ее массы, применения новых материалов, совершенствования конструктивных...
-
Исследование радиофизических свойств ненаполненных полимерных пленок В настоящее время существует потребность в создании радиопоглощающих материалов для...
-
Подготовка материалов к плавке., Технология плавки. - Конструкция и принцип работы елктропечи
Все присадки в дуговые печи необходимо прокаливать для удаления следов масла и влаги. Это предотвращает насыщение стали водородом. Ферросплавы...
-
Практическое использование аморфных сплавов - Принцип получения аморфных материалов
Использование аморфных сплавов в качестве диффузионных барьеров устройств привело к тому, что линейные размеры токоведущих дорожек, контактных площадок и...
-
Для повседневного платья на первом плане функциональные и эргономические требования, такие как воздухопроницаемость, гигроскопичность, и несминаемость, а...
-
Биоразлагаемый материал на основе полиамида и натурального каучука
БИОРАЗЛАГАЕМЫЙ МАТЕРИАЛ НА ОСНОВЕ ПОЛИАМИДА И НАТУРАЛЬНОГО КАУЧУКА В мире существует проблема, которая остро нуждаются в применении искусственных...
-
Стальной аппарат с мешалкой. Он состоит из корпуса и перемешивающего устройства с приводом. Корпус! включает в себя: цилиндрическую обечайку с приварным...
-
Композиционные материалы - Неметаллические материалы
Композиционные или композитные материалы - материалы будущего. После того как современная физика металлов подробно разъяснила нам причины их...
Биокерамические материалы - История создания и развития биоматериалов