Геном пластид - Генетика пластид
В 1961 году X. Рис и В. Плаут обнаружили, что участок хлоропласта в одноклеточной водоросли хламидомонады окрашивается положительно по Фельгену. При электронно-микроскопическом исследовании выяснилось, что он электронно-прозрачный и содержит тонкую сеть фибрилл толщиной 25-30 А. При обработке ДНК-азой фибриллы исчезали. Это свидетельствовало о присутствии ДНК в пластидах.
Естественно, что эта основополагающая работа вызвала большой интерес и стимулировала соответствующие исследования, вследствие которых ДНК-содержащие фибриллы были обнаружены в разных типах хлоропластов, а затем и в митохондриях. Было показано наличие ДНК в хлоропластах бурых, красных водорослей, динофлагеллят, высших и низших растений. Сегодня уже молекулы ДНК выявлены более чем у тысячи видов. Затем было продемонстрировано наличие ДНК и у других типов пластид - амилопластов и хромопластов. При этом использовали разнообразные методы: радиоавтография, цитохимия, электронная микроскопия, ферментативный гидролиз и т. д.
ДНК в хлоропластах располагается в электронно-прозрачных участках. В развитых хлоропластах обычно имеется несколько таких участков (от 3-х до 8-ми), обычно они располагаются вблизи тилакоидов и часто даже ограничены тилакоидными мембранами. В лейкопластах и хромопластах эти участки более расплывчаты. В пропластидах чаще всего один такой участок и часто небольшой.
Интересно, что у динофлагеллят участок хлоропласта, содержащий ДНК, очень большой - 1,5 нм, а в покоящихся цистах он даже окружен двойной мембраной, образованной из ламелл хлоропластов и содержит маленькое концентрическое тельце, похожее на ядрышко. И это ядрышко имеет скопления рибосом.
ДНК-содержащие участки пластид похожи на нуклеоиды бактерий и не похожи на ядерный хроматин. По крайней мере, если судить по внешнему виду. В этих участках происходит синтез ДНК, РНК, рибосом.
Существует определенная связь между местом образования крахмального зерна, липидными включениями и нуклеоидом хлоропластов. Обычно синтез крахмального зерна и липидных включений происходит как раз в том месте, где имеется ДНК-содержащий участок.
У некоторых водорослей вместо нескольких нуклеоидов наблюдается длинная трубчатая структура в виде баранки, располагающаяся по периферии всего хлоропласта. Таким образом, все нуклеоиды соединены в кольцо.
У высших растений нуклеоиды чаще сферичны или линзообразны. Под действием света начинается дифференцировка пластид и вместе с этой дифференцировкой размер таких нуклеоидов увеличивается в несколько раз и содержание ДНК в них повышается. Деление нуклеоида хлоропласта протекает синхронно с делением самого хлоропласта. Нуклеоид, как и сама пластида, вытягивается, приобретает гантелевидную форму и намечается место перешнуровки. Синтез ДНК непосредственно предшествует этому процессу.
Интересно отметить, что репликация пластидной ДНК не синхронизирована с репликацией ядерной ДНК. Репликация пластидной ДНК может быть индуцирована светом.
Так же, как и у бактерий, молекулы ДНК связаны с мембраной хлоропласта. ДНК при помощи специального белка присоединена к мембране тилакоида или к окружающей мембране хлоропласта.
Когда хлоропласты разрушают при помощи осмотического шока, фракция ДНК всегда оказывается связанной с мембранами хлоропласта и освободить ее можно, только разрушив эти мембраны детергентами или обработав проназой. Вероятнее всего, что прикрепление ДНК к мембране позволяет распределять молекулы ДНК вдоль всего хлоропласта по мере роста и развития этих мембран. По аналогии с бактериальной клеткой предполагается, что мембранное прикрепление ДНК служит для сегрегации реплицирующихся молекул, в этом же месте мембраны находятся ферменты, участвующие в репликации ДНК.
Хлоропласты, как высших растений, так и водорослей содержат ДНК столько же, сколько и бактериальная клетка: 10-14 - 10-15 мг ДНК на 1 хлоропласт. В ядре клетки растений, для сравнения, ДНК на четыре порядка больше, т. е. в ядре ДНК больше в десять тысяч раз. Но поскольку ядро в клетке только одно, а хлоропластов может быть много, то общее соотношение ядерной ДНК к пластидной примерно 100 к 1. Это соотношение зависит от стадий жизненного цикла растений, т. к. в диплоидных клетках количество ядерной ДНК неизменно, а количество хлоропластной может изменяться. При старении клеток количество ДНК в пластидах может уменьшаться. Иногда находят пластиды вообще без ДНК. При переходе хлоропластов в хромопласты при осеннем старении листьев наблюдается сокращение количества ДНК на пластиду. Как функционируют пластиды, потерявшие ДНК при дифференцировке, неизвестно. Возможно, они используют генные продукты тех пластид, которые имеют ДНК.
Число копий молекул ДНК на пластиду колеблется. У одноклеточной водоросли хламидомонады, например, 24 - 26 копий в генеративной и вдвое больше в вегетативной клетке. У эвглены приходится около 30 копий на пластиду, а на клетку около 400 копий хлоропластной ДНК. В клетках мезофилла высших растений может содержаться от 1900 до 50 000 хпДНК (табл. 3).
Таблица 3. Максимальные количества хпДНК в листьях растений
|
Растение |
% от тотальной ДНК |
Число геномов на клетку |
Число геномов на пластиду |
|
Горох |
12 |
10000 |
270 |
|
Соя |
17 |
13000 |
- |
|
Шпинат |
23 |
13000 |
200 |
|
Свекла |
11 |
1900 |
100 |
|
Картофель |
8 |
3000 |
22* |
|
Пшеница |
17 |
50000 |
900 |
* Поскольку у картофеля анализировали только зрелые листья, не исключено, что данный показатель у молодых листьев намного больше чем 22.
На вопрос, каков биологический смысл такого значительного количества копий хлоропластной ДНК, можно привести следующие соображения:
1. Для обеспечения репликации пластид.
Для обеспечения консерватизма генов, обеспечивающих фотосинтез.
Для быстрого запуска процесса фотосинтеза и поддержания его эффективности.
Хлоропластная ДНК и ядерная ДНК отличаются по своим физико-химическим параметрам даже у одного и того же вида.
Различия по физико-химическим свойствам ДНК свидетельствуют о различиях в их нуклеотидном составе. Определить нуклеотидный состав ДНК можно, как известно, несколькими способами. Например, прямым биохимическим анализом или определением плотности ДНК в градиенте хлористого цезия при центрифугировании или по температуре плавления. Чем выше плотность или температура плавления, тем выше процентное содержание в молекуле ДНК Г+Ц пар.
Сравнивая плавучую плотность или температуру плавления ядерной и хлоропластной ДНК, можно заключить, что процент Г+Ц пар ДНК пластид может отличаться от ядерной в одну сторону у одних видов, в другую - у других, а у третьих вообще не обнаруживают различий между хлоропластной и ядерной ДНК по этому показателю. Это, возможно, свидетельствует о том, что эволюция хлоропластной и ядерной ДНК протекает относительно независимо друг от друга. У большинства высших растений содержание Г+Ц пар находится в пределах 37-39%, однако у мха печеночника и водоросли эвглены оно значительно ниже - 32% и 25%, соответственно. В разных участках молекулы пластидной ДНК содержание Г+Ц пар также может быть различным и значительно колебаться (от 23% до 44%), что свидетельствует о внутренней гетерогенности молекулы.
Ранее считали, что хлоропластная ДНК не содержит метилированных оснований, в частности 5-метилцитозина, который содержится в митохондриальной ДНК. Сейчас известно, как минимум, два случая наличия этого редкого основания. А в хромопластной ДНК зрелых томатов, например, до 1/3 всего цитозина замещено на 5-метилцитозин. Вероятно, это механизм блокировки фотосинтеза в плодах, ускоряющий созревание плодов и семян.
При анализе кривых плавления ДНК хлоропластов было показано, что у большинства растений хлоропластная ДНК плавится как сравнительно гомогенная молекула, не содержащая различных по нуклеотидному составу участков. У некоторых водорослей определенная гетерогенность молекул ДНК хлоропластов все же обнаруживается.
Геном пластид, как водорослей, так и наземных растений представлен, как правило, кольцевой двунитевой молекулой ДНК, содержащей от 70 до 400 тысяч пар оснований (рис. 9). Хотя в основном геном пластид высших растений представлен 120-217 тысяч пар оснований.

Рис. 9. Электронная микрофотография кольцевой молекулы хпДНК подсолнечника (инбредная линия 3629).
Пластидные ДНК таких размеров способны потенциально кодировать (информационная емкость пластома) от 70 до 150 различных полипептидов. Так как хлоропласты содержат несколько сот различных белков, то большинство белков этих органелл кодируется не пластидной ДНК, а ядерной.
Изучение хлоропластного генома различных видов растений показало, что структура хлоропластного генома весьма консервативна, а генетический материал организован скорее по прокариотическому, чем эукариотическому типу.
ДНК хлоропластов не содержит большого количества высокоповторяющихся нуклеотидных последовательностей, что отличает ее от ДНК ядра. Таким образом, хлоропластный геном высоко конденсирован по сравнению с геномом ядра эукариот. В самом крайнем случае в хлоропластном геноме риса содержится не более 32% некодирующих последовательностей, а в хлоропластном геноме других видов высших растений и того меньше, в то время как в ядерной ДНК высших растений более 90% составляют некодирующие последовательности.
ДНК хлоропластов содержит рибонуклеотидные вставки. Их длина составляет от 10 до 20 нуклеотидов. У гороха, например, имеется 19 таких вставок. С помощью ДНК-ДНК гибридизации установлено, что даже у неродственных видов растений, по крайней мере, 30 % последовательности хлоропластной ДНК гомологичны. Даже геном хлоропластов эвглены, который имеет целый ряд уникальных характеристик, содержит почти полный набор тех же самых генов, что и большинство наземных растений. Консервативные последовательности распределены по молекуле вместе с дивергирующими, что, вероятно, отражает наличие кодирующих и некодирующих последовательностей. Именно кодирующие последовательности чаще всего и являются наиболее консервативными.
Обнаружено, что хлоропластная ДНК из листьев шпината существует по крайней мере в виде 4-х определенных форм с молекулярной массой моно-, ди-, три - и тетрамера.
Однако в какой бы форме не обнаруживали хлоропластную ДНК, основу ее организации составляют длинные кольцевые молекулы, содержащие всю полноту генетической информации пластид.
Хлоропластная ДНК содержит инвертированный (обратный) повтор (10-76 т. п.н.), несущий гены рРНК. Этот повтор сохраняется на протяжении более чем 400000000-летней эволюции растений. Некоторые виды бобовых Pisum sativum, Vicia faba имеют только одну его копию, а у других - Geranium - он представлен в 3-х копиях.

Рис. 10. Генетическая карта хлоропластной ДНК табака.
Геном состоит из большого - 8686 п. н. и малого -18571 п. н. однокопийных районов и двух инвертированных повторов размером 25431 п. н. каждый. Гены, изображенные внутри круга, транскрибируются по часовой стрелке, гены, изображенные снаружи - против.
В хлоропластной ДНК пшеницы, риса и клевера было обнаружено семейство диспергированных повторов. Причем, если для хпДНК злаковых описаны короткие повторы, то клевер Trifolium subterraneum является уникальным среди известных растений, размеры его повторов достигают сотен пар нуклеотидов. Интересно, что хлоропластный геном этого вида, имеющий продолжительные повторяющиеся последовательности, характеризуется и наличием многочисленных структурных перестроек.
Однако у подавляющего большинства видов высших растений хлоропластный геном несет два инвертированных повтора, между которыми расположены два однокопийных района - большой и малый (рис. 10).
В хлоропластных геномах некоторых видов обнаружены так называемые "горячие точки" - места, где перестройки последовательности ДНК происходят наиболее часто. В этих районах находят инверсии, инсерции и делеции. Если точковые мутации, чаще всего, существенно не влияют на функционирование хлоропластов, то протяженные инсерции/делеции не только влияют, но и служат, в определенной мере, дополнительным фактором видообразования. Так, при исследовании 3-х видов табака было выявлено, что вид Nicotiana acuminata имеет пластидный геном размером 171 т. п.н., другой вид - N. tabacum пластидный геном размером 160,5 т. п.н., а третий вид N. knightiana пластидный геном размеров 160,0 т. п.н. Исследования показали, что делеция 11 т. п.н. пластидного генома N. acuminata дала начало пластидному геному N. tabacum, а вторая делеция 0,5 т. п.н. у N. tabacum привела к образованию пластидного генома N. knightiana.
Было установлено, что у табака мутации происходят, в основном, в большой однокопийной области, граничащей с правым сегментом инвертированного повтора, частота же мутаций внутри повтора, как правило, невысока. Однако у Oenothera именно там обнаруживаются структурные изменения. Но это скорее исключение, чем правило.
Сходные результаты были получены и при изучении хлоропластных геномов у видов пшениц Triticum и Aegilops. В этом случае удалось показать, что делеции в геноме одного из видов Aegilops crassa привели к возникновению хлоропластных геномов двух других видов: Ае. squarrosa и Triticum aestivum. Последний вид является важнейшим хлебным злаком - мягкой пшеницей.
К середине 80-х годов целый ряд хлоропластных нуклеотидных последовательностей был идентифицирован и секвенирован. В 1986 году впервые у двух видов растений табака и маршанции японские исследователи полностью определили всю последовательность хлоропластной ДНК. В настоящее время хлоропластная ДНК полностью секвенирована у несколько десятков видов видов. Данные о полном сиквенсе геномов пластид у разных видов растений демонстрируют большое сходство их общей организации.
Пластида генетика органелла мутантный
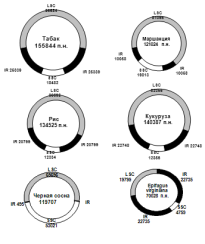
Рис. 11. Размеры и расположение основных областей хлоропластных ДНК у разных видов
R - инвертированный повтор с генами рибосомальной РНК; LSC - большая однокопийная область; SSC - малая однокопийная область.
Больше всего различий находят в размерах инвертированных повторов. У сосны черной они крайне редуцированы и составляют всего 495 пар нуклеотидов, тогда как у покрытосеменных они достигают размера от 12 т. п.о. до 25 т. п.о., что даже больше, чем размер малого однокопийного района. Инвертированные повторы у некоторых видов (эвглена, горох, бобы, люцерна) вообще отсутствуют, а у водоросли Porfira purpurea вместо инвертированного повтора присутствует прямой повтор.
Соотношение размеров большого и малого однокопийных районов также весьма изменчиво: у кукурузы, например, они различаются почти в 7 раз, тогда как у сосны черной только на 20%.
Сам по себе полный сиквенс еще не позволяет выявить гены, кодируемые ДНК пластид. До того как был сделан полный сиквенс пластидной ДНК, были построены физические карты при помощи разрезания молекулы ДНК рестриктазами и определения последовательности расположения рестриктных фрагментов. Затем на физической карте было определено положение генов, кодирующих молекулы рибосомальных и транспортных РНК пластид. Это было сделано при помощи использования меченых молекул РНК и их гибридизации с определенными рестриктными фрагментами ДНК.
Для локализации хлоропластных генов, кодирующих белки пластид, использовали определение порядка аминокислот в молекуле белка, затем синтезировали искусственный полинуклеотид, который можно использовать как зонд в гибридизации для определения участка молекулы ДНК, которая кодирует этот белок. Поскольку большинство генов, кодирующих белки пластид, достаточно консервативны, то, определив положение гена у одного вида, можно затем установить его и у другого вида. Затем, накопив достаточно большую информацию о разных генах, можно использовать компьютерную базу данных о тех или иных генетических последовательностях хпДНК и анализировать данные по полному сиквенсу ДНК.
Данные о геноме хлоропластов были получены благодаря огромному количеству самых разных экспериментов. Согласно этим данным хпДНК содержит две основных группы генов. Одна из них - это так называемые "генетические" гены, а вторая - "фотосинтетические" гены.
К первой группе относятся гены, связанные с работой генетического и белоксинтезирующего аппарата пластид.
Гены, кодирующие последовательности 4-х различных хлоропластных рибосомальных РНК.
Гены, кодирующие последовательности 30-31 хлоропластной транспортной РНК.
Гены 19 белков хлоропластных рибосом.
Полимеразные гены.
5. Гены, связанные с регуляцией экспрессии генома пластид: факторы инициации, транскрипции, элонгации.
Ко второй группе фотосинтетических генов относятся:
1. Ген большой субъединицы рибулезобифосфаткарбоксилазы/ оксигеназы.
Гены белков фотосистемы I и II.
Гены комплексов цитохромов b/f.
Гены АТФ-синтетазы.
Еще одна, третья группа генов, обнаруженная в геноме пластид, - это нуклеотидные последовательности, гомологичные последовательностям NADH-дегидрогеназе митохондрий. Показано, что эта группа генов кодирует 11 белков, входящих в состав дыхательной цепи митохондрий. Выявлено, что эти гены транскрибируются. Однако до сих пор не доказано, что в пластидах имеется полноценная дыхательная цепь.
Кроме того, в геноме пластид обнаружено около 30 неидентифици-рованных, открытых рамок считывания размером от 31 до 2136 п. н. Вероятно, это неидентифицированные гены хлоропластного генома.
Многие из кодируемых хлоропластным геномом полипептидов входят в состав сложных комплексов, в которых, по меньшей мере, один из компонентов кодируется ядром. Так, большая субъединица рубулозобифосфаткарбоксилазы/оксигеназы (основного белка фотосинтеза) кодируется хлоропластным геномом, а малая - ядерным. Из восьми субъединиц АТФ-азного комплекса геномом хлоропластов кодирует только 5, а три - ядерным геномом. Из 30 полипептидов, которые идентифицированы как белки фотосистемы I и II и цитохромного комплекса, хпДНК кодирует 13, а ядерная - 6. Какая ДНК кодирует еще 21 белок, пока неизвестно.
Способность хлоропластного генома кодировать, только небольшую часть необходимых белков связана с переносом части функций в ядерный геном и установлением с ним интегративных связей.
Это предположение подтверждается рядом фактов, полученных при сравнительном изучении геномов пластид у представителей различных таксономических групп растений.
Так, например, если сравнивать геном пластид водорослей и наземных растений, то оказывается, что они различаются между собой по наличию гена, кодирующего белковый фактор элонгации хлоропластов. У водорослей этот ген находится в геноме пластид, тогда как у всех наземных растений совершенно идентичный ген обнаруживают в геноме ядра. Объяснить этот феномен можно только как перенос данного гена из пластидного генома в одну из хромосом ядра. Это событие произошло, вероятно, около 400 миллионов лет назад, и может быть, именно благодаря ему улучшились интегративные взаимодействия между ядерным и хлоропластным геномами, что, возможно, и привело к возникновению высших растений.
Второй пример. Если сравнивать хлоропластный геном бобовых растений и всех других видов, то оказывается, что у бобовых один из генов, кодирующих рибосомальный белок хлоропластов, ген rр122 находится в ядерном геноме, тогда как у других высших растений этот ген содержится в хлоропластном геноме. Может быть, именно благодаря переносу пластидного гена в ядерный геном примерно 75 миллионов лет назад и возник предок бобовых растений, давший столь полезные для человечества виды, способные в симбиозе с клубеньковыми бактериями обогащать почву азотом?
Прокариоты и пластиды имеют сходные 70S, а не 80S рибосомы, почти идентичные последовательности рибосомальной и транспортной РНК, у них отсутствуют полиадениловые последовательности на матричной РНК. Т. е. многие свойства пластидного генома и его белоксинтезирующего аппарата проявляют большое сходство с таковыми у прокариот. Рибосомы также являются продуктом двойного кодирования. Часть их белков и РНК кодируется хп ДНК, в то время как другая часть - ядерной.
Несмотря на большое сходство пластидного генома с прока-риотическим, ряд признаков делает геном пластид похожим и на эукариотический. Так, в геномах хлоропластов показано наличие интронов. Сначала они были найдены в последовательностях хпДНК у кукурузы, табака, сои, а затем и в хлоропластах, как водорослей, так и почти всех наземных растений. Хлоропластный геном Euglena gracilis содержит до 50 интронов. Наличие интронов во многих кодирующих белок генах демонстрирует значительное сходство генома пластид с эукариотами. Однако ДНК пластид не связана с гистонами, является кольцевой молекулой, и она близка по количественному содержанию к геному бактериальной клетки или к геному синезеленых водорослей. Синезеленые водоросли, которые считаются предками хлоропластов и содержат много с ними общих генетических последовательностей, интронов не имеют так же, как и другие прокариоты. Исключение составляют только архибактерии.
Некоторые из выявленных в хлоропластном геноме интронов обладают транспозонными свойствами.
Естественно, что если многие хлоропластные гены содержат интроны, то имеют место и посттранскрипционные процессы, такие, как процессинг и сплайсинг. Эти процессы играют очень важную роль в экспрессии хлоропластных генов, пластидном биогенезе, дифференцировке тканей, реакции растений на изменение окружающей среды.
Сравнительно недавно в пластидах был обнаружен еще один генетический механизм, так называемое РНК редактирование. При этом, как оказалось, модифицируются практически все кодирующие районы в матричной РНК, элиминируются инициирующие и терминирующие кодоны, заменятся обычно цитозин на урацил (изредка происходит и обратный процесс), В результате изменяется консервативный порядок аминокислот в молекуле белка и самое интересное заключается в том, что при этом возникает по настоящему функциональный белок. Было показано, что транслируются как редактированные, так и нередактированные матричные РНК, но полноценный в функциональном отношении фермент возникает только с редактированных матричных РНК.
Биологическое значение РНК редактирования было эффектно продемонстрировано путем введения сайта редактирования из генома пластид шпината в пластиды табака. В результате неправильного редактирования матричной пластидной ДНК появился фенотип, воспроизводящий фотосинтетический мутант с полной неспособностью к фотосинтезу.
Кроме того, демонстрация тканеспецифичности процесса редактирования показывает, что в одних тканях растения происходит частичное редактирование мРНК, в других - полное, что вероятно приводит к созданию из одной генетической последовательности разных генных продуктов, которые нужны для дифференцировки клеток и тканей.
Хлоропластные геномы имеют три типа промоторов.
Один из них сходен с типично прокариотическим промотором и узнаваем РНК-полимеразой, кодируемой геномом пластид.
Второй узнается исключительно только РНК-полимеразой, кодируемой ядром.
Третий промотор активируется светом. (Он обнаружен пока только для одного из фотосинтетических генов пластид кукурузы.)
Интересно, что и пластидная ДНК-полимераза достаточно высоко гомологична с ДНК-полимеразой кишечной палочки и других прокариот, однако только три ее субъединицы кодируются пластидным геномом, тогда как важный для ее функционирования сигма-фактор кодируется ядром клетки. Вероятно, именно мутация в этой ядерной последовательности и приводит к возникновению генов пластидных мутаторов.
У растений паразитов, утративших способность к фотосинтезу, в пластидном геноме возникли обширные делении, затронувшие и гены всех трех субъединиц пластидной РНК-полимеразы. Однако пластиды у этих растений существуют, и они производят разнообразные генные продукты. Вероятно, этот факт свидетельствует о том, что ядерная РНК-полимераза способна участвовать в процессах синтеза пластидной РНК.
Таким образом, еще раз подчеркнем, что генетическая система пластид несет в себе черты сходства как с геномом клеток прокариот, так и с геномом эукариотических клеток. В то же время некоторые черты организации и экспрессии пластидного генома имеют ряд особенностей, что может быть связано с уникальной ролью этих органелл в растительной клетки.
Прокариотические черты организации генома пластид
- 1. Геном пластид представлен кольцевыми "хромосомами" также как и геном клеток прокариот. 2. Белки основного характера, ассоциированные с пластидной ДНК в "хромосоме", сходны с гистоноподобными белками эубактерий. 3. Надмолекулярная структура генома пластид и бактерий также сходна. В обоих случаях ДНК, связанная с белками, образует компактные структуры - нуклеоиды, морфология которых очень близка в пластидах и клетках прокариот. 4. И в пластидах, и в эубактериях "хромосомы" закреплены на мембранах. 5. Многие гены пластид гомологичны генам соответствующим генам клеток E. сoli, т. е. обнаруживают сходство по нуклеотидной последовательности. 6. Регуляторные элементы транскрипции сходны в пластидах и прокариотических клетках. Для пластидных генов характерен прокариотический тип промоторных последовательностей, обнаруживающих значительную гомологию с таковыми в клетках E. сoli (-10- и -35- блоки). 7. Промоторы соседних генов в клетках E. сoli часто регулируются вместе и не функционируют порознь. То же самое наблюдается в пластидах. Так, гены субъединиц двух ключевых ферментов фотосинтеза, катализирующих синтез АТФ и фиксацию СО2 (atpB и rbcL), в геноме пластид расположены рядом. Промоторы этих генов также не функционируют независимо. Предполагают, что взаимодействие между близко расположенными промоторами, является общим контрольным механизмом транскрипции пластидных генов. 8. У некоторых генов пластид наблюдается перекрывание трансляционных стоп/старт - сайтов (ген psbS, например, перекрывается с геном psbD, ndh3, сpsbG), что также характерно для прокариотических генов. 9. Большинство пластидных генов образуют опероны и траскрибируются в полицистронные мРНК, причем некоторые опероны пластид по структуре очень сходны с оперонами E. сoli (опероны рРНК, опероны рибосомных белков, сходные с оперонами str, S10, spc и - клеток E. сoli, а также опероны субъединиц АТР-азного комплекса). 10. За небольшим исключением, мРНК пластид на 3/-конце содержат инвертированные последовательности, которые потенциально могут образовывать структуры типа стебель - петля. Показано, что последовательность CUUCGG, находящаяся в петле такого обращенного повтора на 3/-конце мРНК гена psbA шпината, определяет стабильность мРНК. Такие же последовательности в петле обращенного повтора характерны для прокариотических организмов и связаны с необычно высокой стабильностью мРНК. 11. В пластидном геноме обнаружены гены, гомологичные генам -, - и /-субъединиц РНК-полимеразы E. сoli. Ген, кодирующий - субъединицу, в геноме пластид не обнаружен, однако, в хлоропластах шпината выявлены полипептиды (90 и 33 кДа), иммунологически родственные - субъединице РНК-полимеразы E. сoli, а аппарат транскрипции хлоропластов горчицы содержит три различных транскрипционных фактора (67, 52 и 29 кДа), сходные с бактериальным - фактором. Предполагают, в условиях in vitro транскрипция в хлоропластах может контролироваться этими факторами. Показано, что они "работают" с РНК-полимеразой E. сoli и фрагментами ДНК, содержащими промоторы хлоропластных генов. 12. РНК-полимераза пластид прекращает синтез РНК на пяти независимых терминаторах транскрипции E. сoli. Два прокариотических терминатора транскрипции: thrA (из E. coli) и hisA (из S. typhimurium) - эффективно узнаются РНК-полимеразой пластид.
Эукариотические черты организации генома пластид
- 1. Наличие интронов в некоторых пластидных генах. 2. Наличие интронов в пластидных генах указывает на то, что для формирования зрелых молекул мРНК в пластидах действовуют механизмы сплайсинга. В результате экспрессия таких генов пластидной ДНК не может происходить в системе сопряженной транскрипции - трансляции, как это имеет место в прокариотической клетке. 3. Наличие последовательностей типа ARS (autonomous replicating sequence), аналогичных последовательностям, ответственным за автономную репликацию плазмид у дрожжей. 4. Как и у эукариот, в пластидах наблюдается посттранскрипционное присоединение триплета ССА к 3/-концу тРНК.
Особенности генома пластид и его экспрессии.
- 1. Полуавтономность и мультикопийность генома. 2. Наличие длинного инвертированного повтора. 3. Наличие интронов, кодирующих белки и некоторые особенности механизма сплайсинга (транс - сплайсинг, автосплайсинг). 4. В транскрипции пластидных генов участвуют как минимум две РНК - полимеразы в отличие от клеток бактерий, где имеется лишь одна РНК-полимераза, и клеток эукариот, где каждый вид РНК считывается специфической РНК - полимеразой.
Знания, накопленные в последние годы об устройстве генома хлоропластов, позволили не только получить много новых сведений, о механизмах реализации генетической информации, но и перейти к реконструкции генетического аппарата этих важнейших органелл клетки, что имеет не только теоретическое, но и практическое значение. В качестве примера можно привести успешный эксперимент по трансформации в геном пластид гена, кодирующего бактериальный токсин, что увеличило уровень устойчивости растений табака к насекомым. Следует отметить, что трансформация этого же гена в ядерный геном табака также обеспечивала экспрессию токсичного для насекомых белка, однако уровень экспрессии в этом случае был в сотни раз ниже. Это объясняется тем, что в клетке листа только одна копия ядерного генома и сотни тысяч копий пластидного. Трансформация новых генов в хлоропласты интересна еще и тем, что пластидные гены наследуются по материнской линии, и будет очень легко сочетать такие гены в линиях и гибридах вместе с любыми ядерными генами.
Похожие статьи
-
Формальная генетика пластид - Генетика пластид
Пластиды - органеллы, локализованные только в клетках высших растений и водорослей. Они ответственны за фотосинтез, хранение разнообразных продуктов...
-
Пластиды - Пластиды: строение, происхождение, взаимопревращения
Пластиды характерны для клеток водорослей и всех высших растений. Эти органеллы имеют на поверхности две мембраны. По окраске и строению выделяют три...
-
Взаимопревращения пластид - Пластиды: строение, происхождение, взаимопревращения
В эволюционном смысле первичным, исходным типом пластид являются хлоропласты, из которых при расчленении тела растений на органы произошли пластиды...
-
Генетический код - Великие открытия в генетике ХХ века
РНК передает инструкции от ДНК для создания белка. Но каков генетический код - последовательность инструкций, которая делать этот процесс возможным? В...
-
Виды пластид, Хлоропласты - Пластиды: строение, происхождение, взаимопревращения
Хлоропласты Хлоропласты содержатся во всех клетках растения, находящихся на свету. Лишь немногие типы клеток освещенных частей растений вместо...
-
"Белые пятна" в генетике белой пегости
Перелистайте старые зарубежные "кошачьи" журналы и книги, присмотритесь к фотографиям - нет, не умиляясь простоте тогдашних лучших представителей пород....
-
РНК-посредник - Великие открытия в генетике ХХ века
За годы до того, как Уотсон и Крик начали определять структуру ДНК, ученые уже знали, что именно ДНК создает белок, который находится в цитоплазме. Но...
-
Законы наследственности - Великие открытия в генетике ХХ века
Когда нас зачинают родители, мы наследуем их черты. Но как они перемешиваются? В середине 19 века монах-августинец по имени Грегор Мендель занялся...
-
Заключение, Список литературы - Пластиды: строение, происхождение, взаимопревращения
Итак, в растительной клетке пластиды обладают собственным геномом и собственным аппаратом реализации генетической информации путем синтеза РНК и белка,...
-
Строение пластид, Строение хлоропластов - Пластиды: строение, происхождение, взаимопревращения
Строение хлоропластов В процессе эволюции хлоропласты приобрели достаточно сложное строение. При их развитии из пропластид происходит образование...
-
Ферменты рестриктазы - Великие открытия в генетике ХХ века
Прорыва, приведшего ко всем предыдущим открытиям, могло и не случиться, если бы не бактериальный вирус, следующее открытие было также сделано благодаря...
-
Происхождение пластид - Пластиды: строение, происхождение, взаимопревращения
Существует две основные теории происхождения митохондрий и пластид. Это теории прямой филиации и последовательных эндосимбиозов. Согласно теории прямой...
-
Наследование голандрического признака - Генетика человека
Таблица 1.Типы наследования некоторых признаков у человека Аутосомный Х-сцепленный Голандрический Рецессивный Доминантный Рецессивный Доминантный Голубые...
-
Хромопласты, Лейкопласты - Пластиды: строение, происхождение, взаимопревращения
Хромопласты характерны для клеток лепестков, плодов, корнеплодов, осенних листьев. Это пластиды оранжево-красного и желтого цвета, образующиеся из...
-
Евгеника - прошлое и настоящее - История генетики человека
Евгеника - наука об улучшении человеческого рода . Это название происходит от греческих слов: eu -"хороший", genesis - " происхождение". Понятие...
-
Основная 1. Алехина Н. Д., Балнокин Ю. В., Гавриленко В. Ф. и др. Физиология растений. Учебник для студ. Вузов. - М.: Академия. 2005. 640 с. 2. Давыденко...
-
Ф. Гальтон как основоположник генетики человека - История генетики человека
Френсис Гальтон родился 16 февраля 1822 года, в семье зажиточного английского банкира и активиста секты квакеров Самуэля Гальтона, в его родовом имении...
-
Важные вехи развития генетики - История генетики человека
- 1944 Освальд Эвери, Колин Маклеод и Маклин Маккарти изолируют ДНК и открывают явление трансформации ( Transforming principle ). - 1950 Эрвин Чаргафф...
-
Альтернативный РНК-переключатель - Великие открытия в генетике ХХ века
С открытием РНК-посредника ученые поняли процесс, с помощью которого ДНК передает инструкции для создания белка цитоплазме. Десятилетиями считалось, что...
-
Генетика человека имеет свои специфические методы исследования, отличающиеся от методов общей генетики. В зависимости от целей исследования были...
-
Генная терапия - Этические и правовые проблемы генетики. Евгеника
Генетические технологии нацелены, прежде всего, на то, чтобы оказывать терапевтическое воздействие на организм человека при генетических заболеваниях,...
-
Массовое обследование (скрининг) населения - Этические и правовые проблемы генетики. Евгеника
С появлением перинатальной диагностики стал возможен скрининг популяций, характеризующихся высокими частотами тех или иных наследственных заболеваний....
-
Двойная спираль - Великие открытия в генетике ХХ века
Еще в 1951 году химическая структура ДНК манила своей неизвестностью. В Англии в Кембридже биолог Джеймс Уотсон и физик Френсис Крик работали над...
-
Мигрирующие гены - Великие открытия в генетике ХХ века
До сих пор после рассмотрения работ Менделя , Моргана и Бидла с Тейтумом мы лишь видели, как гены передаются, где они находятся и как они работают, но...
-
Основы селекции были известны скотоводческим народам с глубокой древности. В Спарте неполноценных по тем или иным критериям детей, с отклонениями от...
-
Строение хромопластов, Строение лейкопластов - Пластиды: строение, происхождение, взаимопревращения
Внутренняя мембранная система в них обычно отсутствует. Лишь иногда она представлена одиночными тилакоидами. По размерам хромопласты меньше хлоропластов....
-
Популяционная генетика - Генетические процессы в популяциях
Популяция (позднелат. populatio, от лат. populus -- народ, население) это совокупность особей одного вида, более или менее длительно занимающая...
-
Особенности наследственности и изменчивости у человека - Генетика человека
Человечество принадлежит к одному виду - Homo sapiens - Человек разумный. К человеку приложимы в полной мере все закономерности биологических процессов,...
-
РНК-вмешательство, генов - Великие открытия в генетике ХХ века
В 1997 году ученые Эндрю Файер и Крейг Мелло провели серию экспериментов, чтобы лучше понять функции отдельных генов. Они ввели искусственную РНК,...
-
Минисателлитные последовательности ДНК - Великие открытия в генетике ХХ века
Лондон, 1985 год. На самолете из Ганы прилетел мальчик, цель его визита - воссоединиться с матерью. Но инспекторы таможни подозрительны: оказалось, что...
-
Основной закон популяционной генетики - Генетические процессы в популяциях
Закон Харди-Вайнберга -- это ключевая закономерность популяционной генетики. Этот закон можно сформулировать следующим образом: в популяции бесконечно...
-
Социальные проблемы генетики. Евгеника - Этические и правовые проблемы генетики. Евгеника
Социальная же проблема - это евгеника. Евгеника - учение о наследственном здоровье человека, а также о путях улучшения его наследственных свойств. В...
-
Заключение - Этические и правовые проблемы генетики. Евгеника
Медицинская генетика во всем мире переживает период ренессанса, что связано, в первую очередь, с успехами молекулярной генетики в исследовании генома...
-
В генетике человека отчетливо прослеживается связь научных достижений с этическими вопросами. Генетика как наука достигла такого прогресса, что готова...
-
Операции по коррекции пола в нашей стране начали делать около 30 лет назад строго по медицинским показаниям. Пересадка органов. Пересадка органов от...
-
Разнообразные методы медико-генетической диагностики являются своеобразной формой реализации евгенических идей. В настоящее время методы генетической...
-
Медико-генетическое консультирование - Генетика человека
Медико-генетическое консультирование - это отрасль профилактической медицины, которая занимается предупреждением рождения детей с наследственной...
-
Наследственные болезни человека - Генетика человека
Наследственные болезни человека можно разделить на две группы: генные заболевания и хромосомные, связанные с нарушением их числа и структуры. Генные...
-
Литература - Основные проблемы генетики и роль воспроизводства в развитии живого
Артемов А. Что такое ген. -- Таганрог.: Изд-во "Красная страница", 1989. Биологический энциклопедический словарь. -- М.: Сов. энциклопедия, 1989....
-
Перинатальная диагностика - Этические и правовые проблемы генетики. Евгеника
Перинатальная диагностика - это генетическая диагностика на этапе внутриутробного развития человека с целью выявления имеющейся генетической патологии...
Геном пластид - Генетика пластид