Сульфидный способ - Тиосульфат натрия
Этим способом в раньше в СССР производили значительные ко-личества тиосульфата натрия. В настоящее время его производят другими способами. Применявшаяся и описанная ниже схема производства является несовершенной, хотя использование этого спо-соба в отдельных случаях может оказаться рациональным при более современном аппаратурном оформлении.
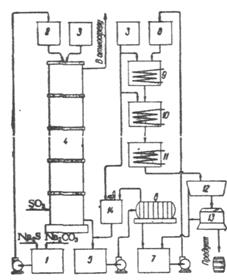
Схема производства тиосульфата натрия сульфидным способом показана на рис. 3.1. Исходный щелок, содержащий 120 - 130 г/л и 60 - 80 г/л Na2CO3, готовили растворением соды в щелоке сернистого натрия или по-лучали при растворении осадков, образующихся в производстве сернистого натрия и извлекавшихся из выпарных котлов (7, ст. 488). Щелок насыщали 6 - 7%-ным сернистым га-зом в керамической аб-сорбционной башне, наса-женной керамическими кольцами.
Рис. 3.1. Схема производства тиосульфата натрия сульфидным способом. 1)резервуар для щелока сернистого натрия; 2) наборный бак для щелока; 3)бак для горячей коды; 4)абсорбционная башня; 5)сборник тиосульфатного щелока; 6) фильтрпресс; 7) сборник фильтрован-ного щелока; 8)напорный бак; 9)подварочный котел; 10)уварочный котел; 11)холодильник; 12)кристаллизатор; 13) центрифуга; 14) вышелачиватель шлама.
Щелок, стекая по насадке навстречу га-зовому потоку, в нижней части башни поглощает SO2, а в верхней - H2S (7, стр. 548). Башня должна иметь высоту, достаточ-ную для полного поглоще-ния сероводорода (6 М При диаметре 1 М). Макси-мального выхода тиосуль-фата достигали при плот-ности орошения насадки ~ 1 М3/(м2 ? ч); уменьше-ние плотности орошения от 6 до 1 М3/(м2 ? ч) увеличивало выход от 63% до 84%, дальнейшее умень-шение интенсивности орошения приводило к сни-жению выхода. После 8 - 10 - дневной непрерывной работы башню промывали горячей водой, так как насадка забивалась шламом, вносимым со щело-ком, и осадком кремневой кислоты, содержащейся в щелоке сер-нистого натрия в виде силиката натрия и выделяющейся из ще-лочного раствора во время его нейтрализации сернистым газом. Из башни вытекал разбавленный тиосульфатный щелок (250 - 300 г/л Na2S2O3), нагретый вследствие экзотермичности реакции до 35 - 40?С. Щелок после фильтрации на фильтрпрессе поступал на выпарку.
Выпарку производили в открытых котлах с паровым обогревом в две стадии. В первой стадии щелок выпаривали до концентрации ~450 г/л Na2S2O3. Конечная концентрация Na2S2O3 в щелоке на разных заводах была в пределах 48 - 57% (700 - 900 г/л). Отстаивали от осадка, содержащего Na2SO3, Na2SO4, NaCl и сливали. Чем выше конечная концентрация щелока, тем больше выделяется осадка и тем больше теряется с ним тиосульфата. Осадок собирали и перерабатывали отдельно разваркой в горячей воде с целью растворения тиосульфата. Полученные при разварке рас-творы присоединяли к щелоку, вытекающему из башни. При пред-варительном выпаривании щелока в подварочном котле (первая стадия) его кипятили 28 Ч При 101 - 104°С, затем подвергали отстаиванию от осадка в течение 8 Ч. Окончательное выпаривание вели также 28 Ч При 104 - 110°С. После вторичного отстаивания от осадка в течение 2 Ч Выпаренный щелок охлаждали до 60 - 62°С в течение 2 - 2,5 Ч В холодильнике, а затем направляли в кристалли-заторы. Выделившиеся при охлаждении щелока до 20 - 30°С кри-сталлы Na2S2O3 Сортировали на три сорта (реактивный, фо-то, технический) и каждый сорт в отдельности отделяли от рас-твора на центрифуге. Маточный раствор возвращали на выпарку.
Растворимость как сульфита, так и сульфата натрия значи-тельно снижается при увеличении концентрации тиосульфата (рис. 3.2).
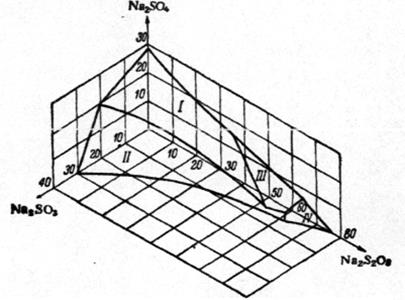
Рис. 3.2. Изотерма растворимости при 25?С в системе
Поля кристаллизации:
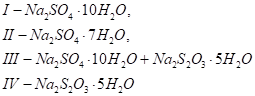
При получении тиосульфата в результате побочных реакций образуются политионаты, разлагающиеся с течением времени с вы-делением серы. Это приводит к пожелтению кристаллов тиосуль-фата, иногда уже при их кристаллизации, иногда при хранении.
Количество выпариваемой воды может быть сокращено в 1,5 - 2 раза, если применять исходный щелок с содержанием не 120 - 130, а 250 - 270 Г/л Na2S и разбавлять его до концентрации 120 Г/л Маточными щелоками от кристаллизации тиосульфата, вместо того чтобы направлять их на выпарку. Присутствие тиосульфата в ще-локе не мешает протеканию основной реакции.
На 1 тонну товарного тиосульфата, получавшегося по описанной выше схеме, расходовали 0,56 т 62,5%-ного Na2S в виде щелока, 0,68 г 45%-ного серного колчедана для получения необходимого количества сернистого газа и 0,05 г кальцинированной соды (в рас-чете на 95%-ную).
Похожие статьи
-
Полисульфидный способ - Тиосульфат натрия
Проводят за уравнением: Для приготовления раствора полисульфида Na2S2 используют горячий раствор сернистого натрия (70?С), обычно щелок, получае-мый...
-
Получение тиосульфата натрия при мышьяково-содовой очистке газов - Тиосульфат натрия
В процессе очистки от сероводорода коксового и других промышленный газов мышьяково-содовым методом, помимо основной реакции: Протекают побочные реакции,...
-
Сульфитный способ - Тиосульфат натрия
Проводят согласно уравнению: Сульфитный способ получения тиосульфата натрия заключается в растворении тонкоизмельченной серы в горячем раствора сульфита...
-
Применение тиосульфата натрия - Тиосульфат натрия
Тиосульфат натрия довольно широко применяется как в быту так и в промышленности. Основными областями применения тиосульфата натрия будут медицина,...
-
Другие способы производства - Тиосульфат натрия
Среди других способов получения тиосульфата прежде всего следует обратить внимание на сероводородный способ, так как он. в отличие от описанных выше, не...
-
В данной главе мы рассмотрим получение тиосульфата натрия. Поскольку тиосульфат натрия широко используется в медицине, промышленности, фотографии. То...
-
Введение, Свойства тиосульфата натрия, Общие свойства тиосульфата натрия - Тиосульфат натрия
Одним из довольно известных химических препаратов является тиосульфат натрия. Раньше о нем знал каждый фотограф и фотолюбитель. Но и на данное время...
-
Тиосульфат натрия широко используется в быту и промышленности. Целью данной работы было рассмотреть использование тиосульфата натрия, методику его...
-
История открытия тиосульфата натрия, Строение молекулы и ее влияние на свойства - Тиосульфат натрия
Имя и время открытия тиосульфата натрия нам не известны. Во всяком случае в истории химии об этом не упоминается. Но в конце XVII и в начале XVIII века,...
-
Способы получения насыщенных растворов - Синтез ацетата натрия ("Горячий лед")
Простейший способ приготовления насыщенных растворов - длительное настаивание растворителя с избытком растворяемого вещества, лучше всего при...
-
Комплексообразующие свойства тиосульфатов - Тиосульфат натрия
Тиосульфат-ион - сильный комплексообразователь, использующийся в фотографии для удаления из фотопленки невосстановленного бромида серебра: Отметим, что...
-
Рассмотрим химические свойства тиосульфата натрия. Изучим его окислительно-восстановительные свойства, взаимодействие с кислотами, комплексообразование....
-
Понятие кристаллизации Кристаллизамция -- процесс фазового перехода вещества из жидкого состояния в твердое кристаллическое с образованием кристаллов....
-
Способы получения элемента. - Галлий
Даже такая, казалось бы, ничтожная концентрация этого элемента, как в золе каменных углей, считается вполне достаточной для его промышленного извлечения....
-
Основная проблема химии и способы ее решения. - Роль химии в повседневной жизни
Основная проблема химии - это не только ее теоретический, но и исторический стержень,- это именно инвариантное ядро химии. При формулировании основной...
-
Химические свойства, Применение - Натрий: свойства и народнохозяйственное значение
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина. Натрий менее активный чем...
-
Введение., Способы получения перхлоратов - Производство перхлоратов в промышленности
Получение перхлората калия или перхлоратов вообще имеет большое значение для промышленности. Ведь перхлораты широко используются как в проведении...
-
Технология производства, Обоснование способа и технологии - Пиролиз углеводородного сырья
Обоснование способа и технологии Проект выполнен на основе действующего производства пиролиза углеводородов нефти объекта 2-3-5/III АО "Уфаоргсинтез",...
-
В сухую колбу Кьельдаля вносят 0,1 г исследуемого продукта, наливают 5 см3 концентрированной серной кислоты. Добавляют небольшое количество катализатора....
-
Основные условия проведения реакции иода с тиосульфатом. - Йодометрия
Заключительным этапом многих йодометрических определе-ний является реакция титрования иода тиосульфатом натрия. Йодометрические титрования выполняют на...
-
Вплоть до 1980-х электронная ионизация (EI) была основным способом ионизации для анализа масс. Однако EI ограничивала химиков и биохимиков малыми...
-
СПОСОБЫ ОПИСАНИЯ СТРУКТУР. МОРФОЛОГИЯ СОЦИАЛЬНО-ПОЛИТИЧЕСКОЙ И ЭКОНОМИЧЕСКОЙ СФЕР Структурное моделирование. Структурный анализ Основная цель...
-
Целью данной курсовой работы является проведение синтеза ацетата натрия (CH3COONa). Задачами курсовой работы являются: изучение методики неорганического...
-
Одно дерево бразильской гевеи в среднем, до недавнего времени, было способно давать лишь 2-3 кг каучука в год; годовая производительность одного гектара...
-
Галургический метод - Производство хлорида калия галургическим способом
Галургический способ выделения хлорида калия из сильвинита или метод избирательного растворения и раздельной кристаллизации основан на различии...
-
Органические кислоты применяются при разложении минерального сырья лишь в единичных случаях, главным образом в фазовом анализе. Наиболее часто для...
-
Введение - Производство хлорида калия галургическим способом
Калийные минеральные удобрения представляют собой природные или синтетические соли и содержат питательный элемент в форме иона К+. В зависимости от...
-
Метод Кьельдаля - обработка серной кислотой так же называют - "мокрое сжигание". Определение количества азота с помощью метода Кьельдаля основано на...
-
Процесс получения винилхлорида сбалансированным методом из этилена состоит из шести стадий: 1. синтез 1,2-дихлорэтана прямым жидкофазным хлорированием...
-
Определение галоида по методу Кариуса. Навеску вещества при нагревании окисляют дымящей азотной кислотой в присутствии нитрата серебра. При этом галоид...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
Задача количественного химического анализа состоит в определении содержания тех или иных элементов в анализируемом материале; при этом главное требование...
-
Способы получения - Свойства графена
Кусочки графена получают при механическом воздействии на высокоориентированный пиролитический графит или киш-графит. Сначала плоские куски графита...
-
Способы формирования выборочной совокупности - Основы эконометрики
Способ отбора Определяет конкретный механизм или процедуру выборки единиц из генеральной совокупности. В практике выборочных обследований наибольшее...
-
Методы устранения жесткости - Жесткость воды и способы устранения
Чтобы избавиться от временной жесткости необходимо просто вскипятить воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с катионами и...
-
Ввод образца был одной из первых проблем в масс-спектрометрии. Для проведения анализа масс образца, который первоначально находится при атмосферном...
-
Наиболее ранним способом формализации экономико-математических и ТС является представление физических явлений с помощью систем дифференциальных...
-
Важнейшей характеристикой раствора является его состав. Содержание растворенного вещества в растворе может быть выражено безразмерными единицами (долями...
-
Заключение, Список литературы - Производство хлорида калия галургическим способом
В данной домашней работе была показана народо-хозяйственная значимость хлорида калия. Рассмотрены области его применения и масштабы производства. Сделан...
-
Способы деаэрации воды и конструктивное выполнение деаэраторов - Деаэрация питательной воды
Для удаления газов из воды могут быть использованы химические и термические методы. Химические методы основаны на избирательном взаимодействии удаляемых...
Сульфидный способ - Тиосульфат натрия