Обнаружение стафилококковых энтеротоксинов - Сущность и обнаружение стафилококковых энтеротоксинов
Проблема большинства бактериальных энтеротоксинов до настоящего времени изучена недостаточно и является весьма актуальной. Имеется большие потребности в разработке доступных высокоэффективных отечественных питательных сред для получения бактериальных энтеротоксинов, унифицированных методов выделения, обнаружения и разработки диагностических препарато для их индикации.
Существуют разнообразные методы обнаружения энтеротоксинов, однако некоторые из них обладают малой чувствительностью, а для использования более чувствительных методов, например иммунологических, необходимо получение диагностических препаратов. Все серологические методы, применяемые для индикации энтеротоксинов, требуют специфической антисыворотки, от качества которой зависит и результативность того или иного метода. В свою очередь высокоспецифичную сыворотку, возможно, получить после иммунизации животных гомогенными препаратами энтеротоксинов. [36,40]
До последнего времени для индикации стафилококковых энтеротоксинов были доступны лишь биологические методы. Однако по мере получения гомогенных препаратов СЭ появилась возможность обнаруживать их иммуносерологическим путем, используя для этих целей специфические антиэнтеротоксические сыворотки. В свою очердь высоко специфичную сыворотку возможно получить после иммунизации животных гомогенными препаратами энтеротоксинов.
В России было проделано большое количество научно-исследовательских работ по обнаружению стафилококковых энтеротоксинов А, В, С и Д. Наиболее значимые для науки работы были проведены в ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН под руководством Флуера Ф. С.: Впервые была предложена унифицированная основа питательной среды для получения бактериальных токсинов, питательная среда для обнаружения СЭА и СЭВ, предложена технология промышленного получения стафилококковых энтеротоксических сывороток типов А и В, разработана производственная технология изготовления иммуноферментной тест-системы для определения СЭА и СЭВ с чувствительностью 2 нг/мл, разработан методологический подход для подготовки культур энтеробактерий для определения энтеротоксина.
Необходимо подчеркнуть, что предложенные диагностические препараты и тесты для определения энтеротоксинов характеризуются доступностью, чувствительностью и быстротой получения результатов., являются высоко специфичными. Они пригодны для индикации СЭ TSST-1, ТЛ энтеротоксина кишечной палочки, энтеротоксина сальмонелл, термолабильного энтеротоксина клебсиелл и энтеробактер., энтеротоксина Bacillus cereus.
Разработанные препараты дают возможность развития нового направления бактериальных энтеротоксинов их изучения и индикации. Они используются как в Российской Федерации так и ближнее зарубежье, поскольку часть из них уже являются коммерческими препаратами.
Следует подчеркнуть, что в настоящее время биологические методы стали усиленно вытесняются серологическими методами.
В настоящее время для индикации СЭ кроме теста кормления обезьян, кошек, котят используют еще тест кормления поросят. Однако, биологические методы индикации энтеротоксинов уступают место серологическим, которые гораздо проще, чувствительнее и дешевле.[38] Недостатком биологических методов является их относительная специфичность и невоспроизводимость. Они непригодны для использования в широкой лабораторной и клинической практике, кроме того, животные менее чувствительны к действию SE, так как позволяют определять только более чем 200 нг SE и поэтому биологические методы индикации энтеротоксинов уступают место серологическим, которые гораздо проще, чувствительнее и дешевле. Для выявления содержания энтеротоксинов в пищевых продуктах, животным (в данном случае кошкам) вводят экстракты из пищевых продуктов в вену, ухо или бедренную вену в количестве 0,5 см3 на килограмм веса тела. Энтеротоксины вызывают рвоту через 30 минут - 5 часов. Рвоту и понос считают положительной реакцией, общее недомогание (вялость, отказ от пищи) - сомнительной, отсутствие - отрицательной реакцией. Каждое животное можно использовать 3 - 4 раза.[6, 33]
Для индикации СЭ используются такие методы как метод простой и двойной гельдиффузии, радиальная иммунодиффузия, встречный иммуноэлектрофорез, электроиммунодиффузия, методы агглютинации, такие как метод ингибирования пассивной гемагглютинации, метод агрегат гемагглютинации, метод непрямой пассивной гемагглютинации, метод латексагглютинации, метод коагглютинации, радиоиммунологические методы, методы иммуноферментного анализа. Расссмотрим эти методы подробнее.[37]
Реакция агглютинации
Реакция агглютинации применяется в лабораторной практике для идентификации выделенных микроорганизмов или для обнаружения специфических антител в сыворотке крови. Механизм реакции основан на взаимодействии детерминантных групп антигена с активными центрами иммуноглобулина в электролитной среде. Реакции протекают в две фазы - соединение антигена с антителом, вторая фаза - выделение в осадок образовавшегося комплекса АГ+АТ. Характер осадка зависит от природы антигена: жгутиковые бактерии дают крупнохлопьевый осадок, безжгутиковые и бескапсулярные - мелкозернистый, капсульные - тяжистый. Существуют два способа постановки реакции агглютинации: пластинчатый и пробирочный. Пластинчатый метод является качественной реакцией и служит для предварительного определения вида микроба. Пробирочный метод используется для определения количественного содержания антител, при этом в пробирках ставится развернутая реакция агглютинации. При положительной реакции на дне пробирки образуется осадок ( агглютинат ). За титр антител принимают последнее разведение, в котором наблюдается четкая агглютинация. Интенсивность оценивается по 4-х крестной системе. Постановка РА должна сопровождаться контролем сыворотки и антигена. Учет реакции агглютинации на стекле производится через 5 - 10 мин, пробирочной - через 18 - 20 часов.[13]
Реактция преципитации
Феномен преципитации заключается во взаимодействии мелкодисперсных антигенов (преципитиногенов) с соответствующими антителами (преципитинами) и образованием преципитата (рис. 1). Постановку РП осуществляют двумя методами: в жидкой среде - по типу реакции флокуляции, кольцепреципитации или в плотной среде в агаре (геле). РП применяют в двух целях: выявление антигенов по известной иммунной преципитирующей сыворотке или антител с использованием известных антигенов. Существует много вариантов постановок реакции, но чаще всего используют следующие методики: реакция преципитации в геле по Оухтерлони, радиальная иммунодиффузия по Манчини, реакция иммуноэлектрофореза, реакция флокуляции, кольцепреципитации.

Рис. 1. Реакция преципитации:1 - антиген; 2 - антитело.
Реакция преципитации в геле по Оухтерлони. Для постановки реакции используют 1% агар Дифко, который разливают расплавленным на предметные стекла или чашки Петри слоем толщиной 0,5 см. В застывшем агаре вырезают лунки диаметром 5 мм специальным приспособлением. В одну лунку помещают взвесь, содержащую исследуемый антиген, в другую - иммунную сыворотку. Антиген и антитела диффундируют в питательную среду, вступают в иммунную реакцию и образуют полосы преципитации. Учет реакции проводят предварительно через 4 часа, окончательно - через 24-48 часов. Реакцию Оухтерлони можно использовать для определения токсичности бактерий, титра антител, активности стандартных диагностикумов или иммунных специфических сывороток (рис. 2).
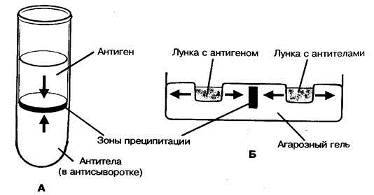
Рис. 2. Реакция преципитации: А - реакция кольцепреципитации ; Б - реакция преципитации по Оухтерлони.
Реакция кольцепреципитации
Данную реакцию применяют для выявления антигенов с помощью иммунной преципитирующей сыворотки, содержащей специфические антитела. Это качественный метод исследования. Реакцию проводят путем наслаивания на иммунную сыворотку среды, содержащей определенный антиген. Реакцию ставят в узких пробирках объемом 0,1- 0,5 мл. В случае соответствия антигена и антитела на границе между ними через 3-5 мин образуется кольцо преципитации (рис. 2). Необходимым условием образования нерастворимого иммунного комплекса является эквивалентное соотношение антигенов и антител. [41]
Радиальная иммунодиффузия по Манчини
Радиальная иммунодиффузия по Манчини позволяет использовать моноспецифические антисыворотки и эталон с известным содержанием антигена. Тест-антиген и разведения растворов, исследуемых на наличие данного антигена, помещают в лунки, вырезанные рядами в пластине геля, куда предварительно внесена соответствующая моноспецифическая антисыворотка.
Антиген диффундирует в гель и, соединившись со специфическими антителами, формирует кольца преципитации, диаметры которых зависят от концентрации антигена в лунках. Полученные результаты используют для построения калибровочной кривой, выражающей зависимость диаметров преципитантов от концентрации антигена в исследуемых растворах (рис. 3). Принцип радиальной диффузии положен в основу метода, применяемого для изучения токсигенности бактериальных культур и отбора из бактериальной популяции клонов с высокой степенью токсичности. В этом случае исследуемые культуры засевают в чашки с агаром, содержащим антитоксическую сыворотку. Вокруг отдельных колоний образуются кольца преципитации, диаметр которых прямо пропорционален степени токсичности штамма (рис. 3). [42]
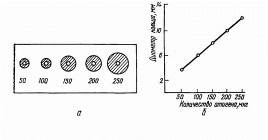
Рис. 3. Простая радиальная иммунодиффузия: а - кольца преципитации;б - калибровочная кривая.
Реакция непрямой гемагглютинации
РНГА применяют в двух вариантах: с известными антигеном для обнаружения антител или с известными антителами для выявления антигена. Эта реакция специфична и применяют ее для диагностики заболеваний вызванных бактериями и риккетсиями. Для постановки РНГА используют эритроцитарные диагностикумы, приготовленные путем адсорбции на эритроцитах антигенов или антител в зависимости от цели исследования (рис. 6). В положительных случаях степень агглютинации эритроцитов отмечают плюсами. Четырьмя плюсами оценивают реакцию, имеющую вид тонкой пленки из склеивающихся эритроцитов (зонтик), покрывающей дно пробирки, наличие пленки с фестончатыми кружевными краями обозначают двумя плюсами. За титр принимают предельное разведение исследуемого материала, вызывавшее агглютинацию эритроцитов на два полюса. [37,38]
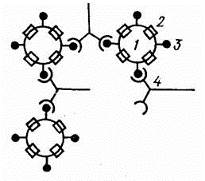
Рис. 6. Реакция непрямой (пассивной) гемагглютинации:
1 - эритроциты;2 - антигенэритроцита ;3 - конъюгированный антиген;4 - антитело.
Метод иммуноферментного анализа
Метод используется для выявления антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой ( пероксидазой хрена, b - галактозой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат и хромоген.
Субстрат расщепляется ферментом, а его продукты деградации вызывают химическую модификацию хромогена. При этом хромоген меняет свой цвет - интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител (рис. 9).
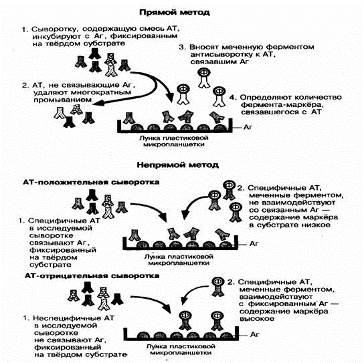
Рис. 9. Иммуноферментный анализ, выявление антигена прямым и непрямым методами твердофазного ИФА.
Наиболее распространен твердофазный ИФА, при котором один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе. В качестве твердого носителя используются микропанели из полистирола. При определении антител в лунки с сорбированным антигеном последовательно добавляют сыворотку крови больных, антиглобулиновую сыворотку, меченную ферментом и смесь растворов субстрата для фермента и хромогена. Каждый раз после добавления очередного компонента из лунок удаляют не связавшиеся реагенты путем тщательного промывания. При положительном результате изменяется цвет раствора хромогена. Твердофазный носитель можно сенсибилизировать не только антигеном, но и антителом. Тогда в лунки с сорбированными антителами вносят искомый антиген, добавляют иммунную сыворотку против антигена, меченную ферментом, а за тем - смесь растворов субстрата для фермента и хромогена. ИФА применяют для диагностики заболеваний, вызванных вирусными и бактериальными возбудителями. [24,38,40]
Метод микрочипов.
Метод микрочипов позволяет проводить одновременный тест на наличие нескольких токсинов в образце, в отличии от традиционных иммунологических методов. Биологические микрочипы, позволяют обнаружить присутствие нескольких соединений (до 120) в анализируемом образце. Для прямого иммуноанализа меченных флуоресцеином энтеротоксинов фирмой Nаоgеn предложены электронные микрочипы с иммобилизованными антителами. Иммобилизация биотинилированых антител на микрочипе осуществлялась путем образования комплексов авидин - биотин на микросайтах, содержащих авидин. Приготовление биологических микрочипов осуществляется следующим образом:
- А) упорядоченный массив трехмерных гидрогелевых ячеек на твердой подложке, содержащих иммобилизованные антитела к различным токсинам или токсины, причем в каждой отдельной ячейке иммобилизовано антитело к индивидуальному токсину или индивидуальный токсин; Б) инкубация микрочипа в реакционной среде, включающей образец, содержащий подлежащие анализу токсины, для образования иммунных комплексов биотоксин - антитело, которую при необходимости проводят в условиях перемешивания; В) определение образовавшегося комплекса; Г) количественное обнаружение анализируемого токсина.
При нанесении на микрочип реакционной среды, содержащей анализируемый образец (биотоксин), происходит образование иммунных комплексов со специфическими лигандами, иммобилизованными в гелевых ячейках микрочипа. Детекцию образовавшегося комплекса и последующее количественное обнаружение проводят в формате прямого, конкурентного или сэндвич - иммуноанализа. К недостаткам описанных в литературе способов анализа токсинов на микрочипах относятся сложная технология изготовления микрочипов: объединение нескольких блоков, подведение каналов для подачи растворов, присоединение электродов. Регистрация сигналов производится с использованием сложной и дорогостоящей аппаратуры: конфокальный микроскоп, Рамановская спектроскопия и др., поэтому микрочипы не применяются на практике из - за необходимости использования дорогостоящего оборудования.[37, 38, 50]
Иммуноблоттинг
Иммуноблоттинг (иногда называемый вестернблоттингом от английского western - западный) - это метод исследования белковых антигенов. Его используют чтобы методы, используемые для определения SE в пищевых продуктах, имели как можно меньший процент как ложноположительных, так и ложноотрицательных результатов. Этого можно избежать при наличии эндогенных пероксидаз в образцах пищи. Метод заключается в том, что смесь известных антигенов перед определением энтеротоксинов разделяют с помощью электрофореза в полиакриламидном геле и переносят на нитроцеллюлозную мембрану с последующим добавлением меченых антител к известным антигенам. Это высокоспецифичный и высокочувствительный метод, подтверждающий результаты, полученные при помощи РПГА или ИФА. Уникальность иммуноблота заключается в его высокой информативности и достоверности получаемых результатов.[60]
Таким образом, из всех методов, используемых с целью определения стафилококковых энтеротоксинов, наиболее чувствительными являются методы радиоиммунологического анализа и обратной пассивной гемагглютинации, наиболее доступными - метод двойной диффузии в геле и ИФА.
Похожие статьи
-
Оптимальные условия для токсинообразования создаются при рН = 6,8 - 9,5. Наиболее активно токсин накапливается в щелочной среде. При повышении...
-
Стафилококковые энтеротоксины - Сущность и обнаружение стафилококковых энтеротоксинов
Стафилококковые энтеротоксины - внеклеточные белки стафилококков, которые синтезируются в виде одной полипептидной цепи. По молекулярному весу они...
-
Стафилококки -- грамположительные сферические клетки, обычно располагающиеся в виде скоплений, неподвижны, не образуют спор, легко окрашиваются всеми...
-
Для частичного или полного уничтожения микробов используют физические, химические, биологические или комплексные воздействия на них. Эффект от таких...
-
Методы определения площади ожога - Сущность ожога
1). Правило ладони (метод И. И. Глумова) применяется для оценки небольших ожогов: площадь ладони человека = 1% площади его тела. 2). Правило "девяток"...
-
ИММУНОЭЛЕКТРОННАЯ МИКРОСКОПИЯ - Методы исследования вирусов
Представляет собой непосредственную визуализацию взаимодействия антигена и антител методом электронной микроскопии, была впервые предложена для...
-
Первая помощь при ожогах - Сущность ожога
Первая помощь при ожогах направлена на профилактику ожогового шока и нагноения ожоговой поверхности. 1). Прекратить воздействие повреждающего фактора,....
-
Естественный отбор - Сущность эволюционной теории Чарльза Дарвина
По Дарвину, эволюция видов в природе обусловливается факторами, аналогичными тем, которые определяют эволюцию культурных форм. Предпосылкой эволюции...
-
ИММУНОФЛЮОРЕСЦЕНТНЫЙ МЕТОД - Методы исследования вирусов
Иммунофлюоресцентный метод, или реакция иммунофлюоресценции (РИФ), используется в микробиологических лабораториях, оборудованных люминесцентным...
-
Общее лечение ожогов - Сущность ожога
1). Профилактика и лечение ожогового шока: Покой, согревание, снятие психомоторного возбуждения (аминазин в/в). Борьба с болью: новокаиновые блокады, при...
-
Сущность живого, его основные признаки - Развитие понятия "жизнь"
Понятие жизнь совпадает с предметом биологии как целостной научной системы (био-логия - наука о живом). Многие ученые склоняются к мысли о том, что...
-
Из всех перечисленных типов питания углеродом фотосинтез зеленых растений, при котором построение органических соединений идет за счет простых...
-
Любой человек имеет свою группу крови, которая никогда не изменяется. Знать это очень важно, так как в случаях необходимого переливания крови, используют...
-
Утрата инфекционности, Серологические методы - Строгие постулаты Коха
Как правило, чувствительность вирионов данного вируса к действию тех или иных инактивирующих веществ определяется специфическими свойствами его белков,...
-
Литература - Сущность эволюционной теории Чарльза Дарвина
Дарвин биологический популяция эволюционный В. А. Бердников. Эволюция и прогресс. Новосибирск, "Наука", 1991. А. В. Ганжина. Пособие по биологии для...
-
Биологическое формирование, будучи развитием органических форм - что оценивается незамедлительно значительно большинством ученых, образовывается на...
-
Введение, Ноосферный проект П. Тейяра де Шардена - Интерпретации сущности ноосферы
В начале XX века почти одновременно возникли, сосуществуют поныне и развиваются две по существу разные интерпретации ноосферы. Такое положение сложилось...
-
Итак, материальная, физико-химическая сущность жизни проявляется, прежде всего, в непрерывном обмене веществ и энергии, который происходит между живой...
-
Представление о сущности жизни в истории науки - Материальная сущность жизни
Исторически сложились две противоположные точки зрения по вопросу о сущности жизни. По философским понятиям их можно оценить как материалистическую и...
-
Диагноз и дифференциальный диагноз - Эпидемиологические особенности бешенства
Предварительный диагноз ставят с учетом эпизоотологических и клинических показателей. Принимают во внимание характер эпизоотической ситуации в данной...
-
Таксономия: отдел Gracilicutes, род Francisella. Возбудитель - Francisella tularensis. Морфология: мелкие кокковидные полиморфные палочки, неподвижные,...
-
Физиологические механизмы памяти - Биосоциальная сущность человека
Для адаптации индивидуального поведения к окружающей среде, тем более для осуществления разнообразной высшей нервной деятельности, человеку, равно как и...
-
Отражение как способ функционирования мозга человека - Биосоциальная сущность человека
Отражение - постоянное свойство любой материи, оно возникает при взаимодействии материальных объектов, процессов, потоков информации, следствием чего...
-
Обнаружено много ископаемых останков древних людей и их предшественников. Современный уровень развития Палеоантропологии и Сравнительной анатомии...
-
Концепции происхождения живого - Сущность живого и проблема его происхождения
Белок обменный живой Попытки решить вопрос о происхождении жизни были предприняты еще в античности. В истории культуры существовало несколько...
-
Определение "живого" - Сущность живого и проблема его происхождения
Для рассмотрения настоящей проблемы сначала необходимо определиться с тем, что мы понимаем под термином "живое", "жизнь". Существует множество трактовок...
-
Введение - Сущность живого и проблема его происхождения
Жизнь - одна из форм бытия и одна из высших форм движения. Однако при всей очевидности, казалось бы, и наглядности феномена жизни познание сущности...
-
Вакцины и анатоксины ОФС.1.7.1.0004.15 - Производство биоферментных препаратов
Настоящая общая фармакопейная статья распространяется на иммунобиологические лекарственные препараты (ИЛП) - вакцины и анатоксины, содержащие компоненты,...
-
Здоровье - одно из важнейших условий полноценного участия человека в жизни общества. Но не всегда люди четко представляют, Что означает понятие...
-
Патологоанатомические изменения, Диагноз - Ассоциативные болезни птиц
При вскрытии трупов цыплят, павших в возрасте от нескольких часов до 7-10 дней, обнаруживают изменения, свойственные септическим заболеваниям. У...
-
Методика выделения ДНК зависит от состава и характера используемого источника (ткани животных или растений, микроорганизмы, вирусы). Для лабораторного и...
-
Популяция - единица эволюции - Сущность эволюционной теории Чарльза Дарвина
Особи любого вида распространены в пределах ареала неравномерно, как бы островами, то есть густонаселенные участки сменяются редконаселенными. В...
-
Вид. Критерии вида - Сущность эволюционной теории Чарльза Дарвина
Вид - совокупность особей, обладающих наследственным сходством морфологических, физиологических и биохимических особенностей, свободно скрещивающихся и...
-
Приспособленность организмов и ее относительность - Сущность эволюционной теории Чарльза Дарвина
В работе "Происхождение видов..." Дарвин отметил важнейшую черту эволюционного процесса - его приспособительный характер. Виды непрерывно...
-
Сущность и состав биосферы - Биосфера. Понятие о биосфере
В буквальном переводе термин "биосфера" обозначет сферу жизни и в таком смысле он впервые был введен в науку в 1875 г. австрийским геологом и...
-
Искусственный отбор - Сущность эволюционной теории Чарльза Дарвина
Исходным положением учения Дарвина является его утверждение о наличии изменчивости в природе. Изменчивостью Называют общее свойство организмов...
-
Местные симптомы (электроожоги): Небольшие (диаметром 2-3 см) округлые участки сухого некроза (знаки тока) с приподнятыми краями и втяжением в центре....
-
Синтез белка - Белок в жизни живых организмов
Биосинтез белка происходит в результате трансляции в субклеточных частицах - рибосомах, представляющих собой сложный рибонуклеиновый комплекс. Информация...
-
Замерзание, Электротравма, Патогенез - Сущность ожога
- это общая патологическая гипотермия человека. Различают следующие стадии замерзания: 1).Адинамическая стадия - проявляется сонливостью, слабостью,...
-
В медицинской микробиологии все шире используются методы генной инженерии, с помощью которых "заставляют" микроорганизмы продуцировать нужные медицинской...
Обнаружение стафилококковых энтеротоксинов - Сущность и обнаружение стафилококковых энтеротоксинов