Введение - Радиационный апоптоз и некроз клеток облученного организма
Еще в начале века были описаны различные реакции клеток на облучение - от временной задержки роста и размножения до полной деградации и лизиса. Выражение эффекта зависела от дозы облучения и особенностей объекта. В 1906 г. Бергонье и Трибондо, обобщив накопленный к тому времени экспериментальный материал, сформулировали общее правило о том, что рентгеновские лучи тем сильнее воздействуют на клетки, чем интенсивнее они делятся и чем менее дифференцированы. Это эмпирическое правило указывало, что ответная реакция клеток на лучевое воздействие зависит от физиологического состояния объекта и его генетической конституции.
С появлением методов культивирования клеток вне организма удалось детально описать характер гибели быстро делящихся малодифференцированных клеток и неделящихся или медленно делящихся высокодифференцированных клеток. Выявление принципиальных различий в реакции на облучение активно пролиферирующих и неделящихся клеточных популяций позволило раздельно исследовать механизмы их лучевого поражения, проявляющиеся феноменом гибели клеток. В зависимости от пролиферативного статуса клеток, а точнее от стадии клеточного цикла, в которой происходит реализация процесса клеточной гибели, различают соответственно репродуктивную и интерфазную гибель. Репродуктивная гибель состоит в нарушении способности делящихся клеток к неограниченному воспроизводству: после 1-2 делений дефектные потомки клеток отмирают. При интерфазной гибели вскоре после облучения гибнут сами облученные клетки. Для всех делящихся и большинства неделящихся клеток интерфазная гибель наступает лишь при дозах в сотни Грей. Исключение составляют лимфоциты и половые клетки на некоторых стадиях их развития; они гибнут интерфазно уже при дозах в несколько десятков Грей.
Причины и закономерности репродуктивной и интерфазной гибели различны. Наиболее изучена репродуктивная гибель. Она наступает в результате повреждения молекулы ДНК, завершающегося разрывом одной или обеих ее нитей, что препятствует дальнейшему воспроизводству нормальных клеток. Зависимость доли клеток, сохранивших репродуктивную способность после облучения в дозе D, имеет вид
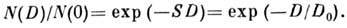
Здесь N(0) и N(D) - число клеток до и после облучения; величина S = 1/D0 характеризует радиочувствительность клеток, D0 - доза, снижающая число выживших клеток в Е раз. Для большинства делящихся клеток D0 = (1,22,0) Гр. Часто экспоненциальному участку дозовой кривой предшествует участок кривой с меньшим наклоном (рис. 1).
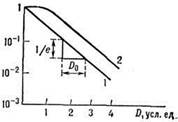
Рис. 1. Зависимость репродуктивной гибели клеток от дозы D; по оси ординат - доля клеток, сохранивших репродуктивную способность; 1,2 - разные формы дозовых кривых.
Радиочувствительность делящихся клеток зависит от многих факторов и может быть искусственно увеличена (сенсибилизация) или уменьшена (защита); соответственно D0 уменьшается или увеличивается. Наиболее эффективным естественным сенсибилизатором является кислород: в его отсутствие поражение различных биол. объектов (макромолекул, клеток, организмов в целом), как правило, ослабляется (кислородный эффект). При этом D0 для клеток увеличивается в 3 раза. С ростом линейной плотности ионизации радиочувствительность клеток и тканей возрастает.
Повреждение ДНК, обусловливающее репродуктивную гибель клетки, не является для нее фатальным благодаря существованию мощных систем восстановления (репарации). Часть возникающих в результате ионизации первичных повреждений репарируется химическими восстановителями, присутствующими в клетке. Основным восстановителем является аминокислота глутатион. Она конкурирует с внутриклеточным кислородом, фиксирующим первичные повреждения, и препятствует их восстановлению. Повреждения, сохраняющиеся после этого физико-химического этапа репарации, эффективно устраняются ферментными системами, специфически репарирующими различные виды генетических повреждений. Конечный поражающий эффект облучения обусловлен неотрепарированной частью первичных повреждений ДНК. Доля их в обычных условиях невелика (доли %), что и обусловливает относительную устойчивость живых клеток к действию ионизирующих излучений. С этим же связана возможность увеличить радиочувствительность, искусственно подавляя способность делящихся клеток к репарации, либо снизить их радиочувствительность, создавая условия для лучшей репарации потенциальных повреждении ДНК.
Механизм интерфазной гибели клеток изучен слабее, неясна и причина резкого отличия в радиочувствительности лимфоцитов от др. видов клеток. В отличие от репродуктивной гибели, изменения, ведущие к интерфазной гибели, наблюдаются во всех клетках и с дозой облучения меняется не доля погибших клеток, а среднее время гибели всей популяции (рис. 2). Причина различий, по-видимому, в том, что интерфазная гибель обусловлена повреждением не уникальной структуры клетки (ДНК), а мембран и др. множественных ее структур.
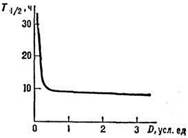
Рис. 2. Зависимость интерфазной гибели лимфоцитов от дозы; по оси ординат - время гибели половины облученных клеток ().
Репродуктивная гибель стволовых клеток, снижающая их численность ниже совместимого с жизнью критического уровня, приводит к гибели организма.
Как репродуктивная, так и интерфазная гибель клеток могут проявляться в двух формах - апоптоза или некроза.
Если вопрос о некротической гибели издавна связывался биологами с решением проблем неспецифической реакции клетки на различные воздействия, то исследование апоптоза непосредственно возникло в радиобиологических лабораториях. Исследование механизмов апоптоза начались с изучения радиобиологической проблемы радиационной гибели клеток млекопитающих. Большая часть работ начального периода изучения этой проблемы была выполнена в нашей стране, хотя первую статью на эту тему опубликовали в США.
В 1957 г. Л. Коулом и М. Эллис в радиочувствительной лимфоидной ткани животных было обнаружено значительное повышение после облучения содержания солерастворимой ДНК, оказавшейся на самом деле фрагментами хроматина, получившими название полидезоксинуклеотидов (ПДН). Эти данные вскоре подтвердила Т. Н. Рысина и Р. Е. Либинзон (1960). В дальнейшем было установлено, что ПНД - это продукты деградации хроматина погибающей части лимфоидной ткани - малых (неделящихся) лимфоцитов, представляющие собой нуклеосомы и их олигомеры с нормальным содержанием гистонов и интактной структурой ДНК-белкового комплекса. Они образуются не в результате образования разрывов ДНК, а под воздействием неких ферментов типа эндонуклеаз (но не ДНКазы II), активность которых может быть понижена введением ингибиторов белкового синтеза, что указывает на их индуцируемую природу.
Было установлено далее, что деградация генетического материала в клетках лимфоидной ткани начинается сразу после прекращения пострадиационной репарации ДНК (которая в этом случае, вероятно, остается незавершенной, неполной) и является необратимым этапом радиационной гибели клеток. Вне зависимости от дозы облучения этот процесс начинается после двух часового лаг-периода и достигает максимальных значений через 6-8 часов после облучения. Деградация хроматина происходит в жизнеспособных по многим показателям клетках, зависит от синтеза белка и функционирования биоэнергетических систем. Ингибиторы этих процессов задерживают деградацию ДНК и проявления гибели клеток.
Распад хроматина происходит по механизму энзиматической межнуклеосомной фрагментации. В гибнущих клетках деградации подвергается большая часть генетического материала, в то время как в клетках, еще не вступивших на путь гибели, она остается интактной. Образующиеся продукты, как уже отмечалось, представляют собой нуклеосомы и их олигомеры.
Деградация хроматина не определяется активацией протеолитических ферментов, ДНКазы I и ДНКазы II и не является, таким образом, следствием автолиза хроматина лизосомными гидролазами. Н. В. Ермолаевой и С. Р. Уманским была установлена природа эндонуклеазы - фермента, осуществляющего межнуклеосомную фрагментацию ДНК, изучены его свойства и причины активации в облученных клетках. Выявлена общность энзиматического механизма деградации хроматина при облучении и действии глюкокортикоидов, алкилирующих соединений и химических индукторов дифференцировки (Н. И. Сорокина, 1984). Совокупность полученных результатов впервые позволила К. П. Хансону рассматривать механизмы, приводящие клетки к гибели, как адаптивный ответ на внешние воздействия различной природы и еще в 1979 г. сфор-мулировать концепцию о существовании внутриклеточной генетической программы, включение которой приводит к деградации генома и гибели клеток. Назначение этой программы в здоровом организме заключается в реализации клеточной гибели в ходе морфо - и эмбриогенеза, в поддержании клеточного гомеостаза тканей и в осуществлении функций цитотоксических лимфоцитов (Т-киллеров). Описанные здесь результаты изысканий отечественных исследователей послужили стимулом и дали "научную канву" для развертывания аналогичных работ за рубежом.
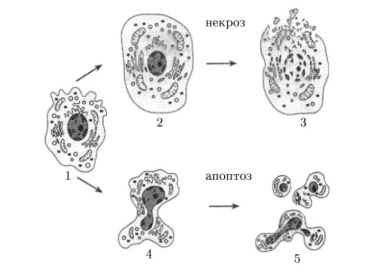
Рис. 3

На рис. 3 представлена картина морфологических изменений клеток при некрозе и апоптозе (В. Д. Самуилов, 2001). Из приведенного рисунка видна отчетливая разница в изменениях ультраструктуры клетки при ее некрозе и апоптозе. Непрограммируемая, патологическая форма гибели клетки (некроз) характеризуется увеличением ее объема (набуханием), деградацией и разрывом клеточных мембран. Вследствие этого происходит разрушение органелл, высвобождение ферментов лизосом, выравнивание клеточных градиентов и выход внутриклеточного содержимого наружу, в межклеточные пространства. В организме некроз является результатом внешнего повреждения клетки, приводящего к остановке в ней метаболизма с полной утратой способности поддерживать ионный гомеостаз, и обычно, сопровождается воспалительной реакцией тканей. Изменение морфологической структуры клетки при апоптозе происходит в результате сморщивания цитоплазматической мембраны, конденсации ядра, фрагментации нитей ДНК и всего ядерного хроматина с последующим распадом клеточного ядра на части. Один из ранних морфологических признаков апоптоза - конденсация хроматина со смещением (маргинацией) к внутренней поверхности ядерной мембраны. Затем происходит фрагментация клетки на мембранные везикулы, включающие в себя фрагменты хроматина, образуются капоптозные тельца".
Клетка внешне "спокойно" (без электрического пробоя и воспаления тканей) распадается на части.
Конечным результатом распада ДНК в клетке при апоптозе является ее расчленение в составе хроматина на двунитевые фрагменты - полинуклеотиды - размером от 50 тысяч пар нуклеотидов до более коротких, олигонуклеотидов, содержащих фрагменты, кратные 180-200 парам нуклеотидов (нуклеосомам). При электрофорезе ДНК хроматина апоптотической клетки представляется в виде нуклеосомной лесенки". Малые, сформированные из мембран и ДНК пузырьки, называемые апоптотическими тельцами, быстро фагоцитируются макрофагами и близкорасположенными эпителиальными клетками без воспалительного (иммунного) ответа, в противоположность воспалительной реакции, наблюдаемой при выбросе внутриклеточного содержимого некротическими клетками. Еще одно различие апоптоза и некроза: первый затрагивает отдельные, расположенные диспергированно клетки, второй охватывает группы клеток, имеющих взаимные контакты.
При учете гибели клеток по пикнозу ядер появление нежизнеспособных клеток в тимусе крыс наблюдается уже через 2 часа после облучения с максимумом через 6 часов после него. При световой и электронной микроскопии цитофотометрические изменения и нарушения ультраструктуры ядер клеток селезенки крыс, облученных в дозе б Гр, обнаруживались в единичных клетках уже к 75 мин. после воздействия. Через 2 часа в ядрах большого числа лимфоцитов селезенки хроматин наблюдался смещенным к периферии, а через 4-6 часов после облучения выявлялся в цитоплазме и вскоре исчезал вообще.
Наконец, в отличие от некроза ("убийства ради убийства" любой клетки), апоптоз направлен на поддержание "общего благам ткани и организма - сохранения нормального клеточного гомеостаза за счет "самоубийства" клеток, ставших лишними или переставших выполнять свои функции.
Похожие статьи
-
Заключение - Радиационный апоптоз и некроз клеток облученного организма
Итак, апоптоз завершается потерей целостности, фрагментацией клетки. Хроматин - главный ядерный компонент, состоящий из ДНК и белков, уплотняется, а ядро...
-
Механизмы апоптоза - Радиационный апоптоз и некроз клеток облученного организма
Развитие и функционирование многоклеточных организмов подразумевает равновесие между синтезом и распадом молекул, их окислением и восстановлением,...
-
Некротическая, беспрограммная форма гибели наиболее характерна для сильных воздействий, например, для облучения клеток и организма в высоких, летальных...
-
Смерть как биологическое понятие является выражением необратимого прекращения жизнедеятельности организма [7]. В любом организме постоянно идет гибель...
-
Клетки и многоклеточный организм - Клеточная теория
Роль отдельных клеток во многоклеточном организме подвергалась неоднократному обсуждению и критике и претерпела наибольшие изменения. Т. Шванн...
-
Введение, Клетки для тканевой инженерии - Тканевая инженерия в медицине
Одним из направлений биотехнологии, которое занимается созданием биологических заместителей тканей и органов, является тканевая инженерия (ТИ). Тканевая...
-
В настоящее время проблема адаптации спортсмена к физическим нагрузкам является одной из актуальных проблем. Проблематика заключается в раскрытии...
-
Жизненный цикл клетки Жизненный цикл-- это время существования клетки от момента ее образования путем деления материнской клетки до собственного деления...
-
Итак, материальная, физико-химическая сущность жизни проявляется, прежде всего, в непрерывном обмене веществ и энергии, который происходит между живой...
-
Введение, Белки - Анализ пищевых веществ, необходимых для организма человека
Организм человека состоит из белков (19,6 %), жиров (14,7 %), углеводов (1 %), минеральных веществ (4,9 %), воды (58,8 %), Он постоянно расходует эти...
-
Размеры бактериальной клетки обычно составляют от 1 до 15 мкм. Форма клеток очень разнообразна: палочковидные (бациллы), сферические (кокки),...
-
Апоптоз - Характеристика основ иммунологии
Пролиферация клеток Количество клеток в ткани регулируется двумя процессами-- Пролиферацией Клеток и " Программированной, или физиологической, гибелью...
-
Б. МЕТОДЫ ИССЛЕДОВАНИЯ КЛЕТКИ - Основные положения учения о клетке
1) Методы исследования структурной организации клетки. Световая микроскопия. * Получение четких изображений мелких (недоступных человеческому глазу)...
-
В большинстве других случаев клеточной пролиферации в период между митозами происходит рост клеток. Клетка увеличивается в объеме почти вдвое и затем...
-
ВВЕДЕНИЕ - Инотропные и вазоактивные средства в реаниматологии и интенсивной терапии
Инотропные и вазоактивные препараты широко используются в клинической практике и по праву могут быть отнесены к числу жизненно важных медикаментозных...
-
Заключение - Концепция взаимодействия энтеросорбентов с внутренней средой организма
Радиобиология решает практические вопросы радиационной гигиены, проблемы отдаленных последствий действия на живые организмы ионизирующих излучений. Одно...
-
Виды клеточной смерти - Биологические механизмы жизненного цикла клетки
Гибель (смерть) отдельных клеток или целых их групп постоянно встречается у многоклеточных организмов, также как гибель одноклеточных организмов. Причины...
-
Введение - Исследование воздействия электромагнитного поля низкой частоты на клетки крови
Электромагнитное поле (ЭМП) окружает нас с самого рождения. Электромагнитная среда нашей планеты определяется в основном электрическим и магнитным полями...
-
Введение - Концепция взаимодействия энтеросорбентов с внутренней средой организма
Радиобиология - наука о действии всех видов ионизирующих излучений на живые организмы и их сообщества. Исследование биологического действия ионизирующих...
-
В многоклеточном организме все сложные проявления жизни возникают в результате координированной активности составляющих его клеток. Задача цитолога -...
-
На примере отряда блох рассмотрим большую группу переносчиков, для которых кровососание характерно лишь на одной из стадий развития -- имагинальной....
-
На примитивной Земле протекали различные химические процессы, но особую роль играли те из них, в основе которых лежит фосфор. В конечном счете именно с...
-
Клетка от клетки - Клеточная теория
Формулировка положения "Всякая клетка от клетки" связана с именем знаменитого ученого Р. Вирхова. Т. Шванн в своих обобщениях подчеркивал одинаковость...
-
Введение - Характеристика основ иммунологии
Мечников открыл первую клетку иммунной системы, которую назвали фагоцит, или макрофаг. Греческое слово "фаг" означает поедание, пожирание. Фагоцитоз был...
-
Транспорт питательных веществ в бактериальную клетку - Физиология микроорганизмов
Пассивный - облегченная диффузия, в следствии разности концентрации питательных веществ, без затрата энергии. Отвечает за транспорт цитоплазматическая...
-
Все нормальные процессы жизнедеятельности человека в какой-то данной среде имеют адаптивный характер. Иначе говоря, все физиологические реакции в...
-
Ионизирующее излучение объединяет в себе радиоактивные излучения ( б, в, г - лучи), жесткое рентгеновское излучение, а также поток протонов и нейтронов....
-
1)Мацерация Препараты костей готовятся методом мацерации (отгнивание, разрыхление, размачивание). Очищенные от мягких тканей кости (скоблить их ножом...
-
Стволовые клетки - Тканевая инженерия в медицине
Стволовые клетки -- недифференцированные клетки, которые имеют способность к делению, самообновлению и дифференцировке в различные типы...
-
Действие на организм и токсичность - Метаболизм этилового спирта в организме
Этиловый спирт может поступать в организм несколькими путями: при приеме внутрь, при внутривенном введении, а также через легкие в виде паров с вдыхаемым...
-
Происхождение вирусов и происхождение клетки - Строгие постулаты Коха
Проблема происхождения вирусов - это, по существу проблема независимости генетических элементов в репродуктивном и эволюционном отношении. Основные...
-
Фагоциты как центральное звено неспецифической защиты организма На современном этапе развития медицинской науки иммунофагоцитарная система...
-
Тотипотентность клеток - Клеточная теория
Как же возникают разнообразные типы клеток в многоклеточных организмах? Известно, что организм человека, развившийся всего из одной исходной клетки,...
-
Говоря о клеточном ядре, мы имеем в виду собственно ядра эукариотических клеток. Их ядра построены сложным образом и довольно резко отличаются от...
-
Введение, Прокариоты - Прокариотические организмы и их роль в биоценозах
В данном реферате мы рассмотрим прокариотов, как отдельную часть живого мира, так же мы рассмотрим строение прокариотов (бактерий) и их размножение при...
-
Введение - Наследственность и окружающая среда как факторы индивидуального развития организма
Последние 30 лет ознаменовались бурным развитием биологических исследований и широким внедрением их результатов в спорте. Учеными из разных стран были...
-
В данной работе мы должны по возможности ясно и коротко описать основные понятия теории П. К. Анохина о функциональных системах, как принципах...
-
Введение - Разнообразие личинок у разных организмов
Происхождение личиночной стадии является предметом оживленной дискуссии зоологов. Очевидно, что личиночная стадия возникала в онтогенезе животных...
-
Вопросам моего исследования посвящено много работ, но в основном материал, изложенный в учебной литературе, носит общий характер. Однако, я думаю,...
-
Введение - Грудная клетка. Изготовление препаратов костей из грудной кости домашнего животного
Анатомия -- наука о форме и строении отдельных органов, систем и организма животных в целом. Первоначально под анатомией подразумевалось искусство...
Введение - Радиационный апоптоз и некроз клеток облученного организма