Механизм некротической гибели клеток (некроза) - Радиационный апоптоз и некроз клеток облученного организма
Некротическая, беспрограммная форма гибели наиболее характерна для сильных воздействий, например, для облучения клеток и организма в высоких, летальных дозах. В основе ее - нарушение окислительно-восстановительного равновесия, достигающее уровня патологии. Так, накапливающиеся в облученной клетке ОРТ, выступают в роли образователей пор в мембранах. Оксирадиотоксины способны окислять тиоловые группы белков, инициировать гидролиз и окисление ненасыщенных фосфолипидов мембран. В результате этого происходит инактивация в мембранах ион-транспортных ферментов-насосов, содержащих сульфгидрильные группы, например, Са2+-АТФазы. Ферментный выход ионов Са2+ из клетки через мембраны тормозится, и они накапливаются в цитозоле.
Ионы Са2+, как известно, являются активаторами фосфолипазы А2, вызывающей гидролиз фосфолипидов внутренней мембраны митохондрий. Образуются фрагменты фосфолипида - свободные жирные кислоты, которые подвергаются дальнейшему окислению с образованием новых ЛРТ. Кроме того возникает и лизоформа фосфолипидов, обладающая также разрушающими, лизирующими свойствами. Развиваются неспецифические процессы дезинтеграции и нарушения структуры БМ. ОРТ, образуясь в высоких концентрациях, воздействуют на фосфолипиды БМ и образуют в них поры. Появившиеся поры увеличивают ионную проницаемость благодаря образованию ионных каналов. В итоге в митохондрии входят ионы калия, а в клетки - ионы натрия.
Одновременно через мембранные поры происходит усиленное прoникновение Н+ в клетку, возрастает градиент протонного потенциала ?µН+. Все эти изменения дают начало дальнейшим серьезным повреждениям мембран митохондрий. Описанные изменения структуры и проницаемости БМ вызывают увеличение осмотического давления внутри клеток и их набухание (рис. 3). Прогрессирующее увеличение градиента ?µН+ может достичь такого уровня, при котором митохондрии теряют важнейшую для энергетики клетки способность - синтезировать АТФ; происходит разобщение сопряжения процессов дыхания и фосфорилирования (В. П. Скулачев, 2000).
Уже одно это может служить причиной последующей гибели митохондрий и клеток. Рост протонного градиента может достичь пороговых значений электрохимического потенциала (называемого "потенциалом пробоя"), когда изменения силы тока от возрастания электрохимического потенциала мембраны уже перестают подчиняться линейной зависимости (по закону Ома). С этого момента ток самопроизвольно возрастает во времени и происходит резкий электрический пробой БМ (так называемой самопробой мембраны).
Происходящее снижение электрической прочности мембраны сопровождается глубокими повреждениями и некротической дезинтеграцией клетки до полного ее разрушения. (рис. 3; рис.4).
Описанный механизм оксидативного повреждения и самопробоя БМ электрическим полем с последующим некрозом клетки в терминальной стадии оксидативного стресса не является специфичным только для ионизирующей радиации. В основе патобиологического эффекта разных физических и химических экстремальных воздействий лежит одно и то же последствие: снижение электрической прочности мембраны, создаваемое разностью электрических потенциалов. Предполагается, что самопробой БМ электрическим полем - универсальный механизм нарушения барьерных свойств мембран в патологии и одна из главных причин смерти клеток в экстремальных неблагоприятных условиях (Ю. А. Владимиров, 2000).
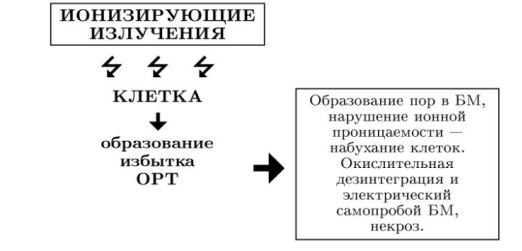
Рис.4
Похожие статьи
-
Заключение - Радиационный апоптоз и некроз клеток облученного организма
Итак, апоптоз завершается потерей целостности, фрагментацией клетки. Хроматин - главный ядерный компонент, состоящий из ДНК и белков, уплотняется, а ядро...
-
Механизмы апоптоза - Радиационный апоптоз и некроз клеток облученного организма
Развитие и функционирование многоклеточных организмов подразумевает равновесие между синтезом и распадом молекул, их окислением и восстановлением,...
-
Введение - Радиационный апоптоз и некроз клеток облученного организма
Еще в начале века были описаны различные реакции клеток на облучение - от временной задержки роста и размножения до полной деградации и лизиса. Выражение...
-
Смерть как биологическое понятие является выражением необратимого прекращения жизнедеятельности организма [7]. В любом организме постоянно идет гибель...
-
В многоклеточном организме все сложные проявления жизни возникают в результате координированной активности составляющих его клеток. Задача цитолога -...
-
Виды клеточной смерти - Биологические механизмы жизненного цикла клетки
Гибель (смерть) отдельных клеток или целых их групп постоянно встречается у многоклеточных организмов, также как гибель одноклеточных организмов. Причины...
-
Итак, материальная, физико-химическая сущность жизни проявляется, прежде всего, в непрерывном обмене веществ и энергии, который происходит между живой...
-
Размеры бактериальной клетки обычно составляют от 1 до 15 мкм. Форма клеток очень разнообразна: палочковидные (бациллы), сферические (кокки),...
-
Молекулярные механизмы регуляции клеточной смерти - Биологические механизмы жизненного цикла клетки
Апоптоз - многоэтапный процесс. Первый этап - прием сигнала, предвестника гибели в виде информации, поступающей к клетке извне или возникающей в недрах...
-
Жизненный цикл клетки - Биологические механизмы жизненного цикла клетки
Биологический клетка деление До сих пор много тайн клетки остаются неразгаданными. Загадочным во многом остается и запрограммированный генетически...
-
Строение растительной клетки - Производство биоферментных препаратов
Биотехнологический хемостат вакцина антибиотик Растительная клетка состоит из более или менее жесткой клеточной оболочки и протопласта. Клеточная...
-
Чем занимаются немедленные ранние гены в клетке? - Технологии изучения клеточных механизмов памяти
Некоторые из них кодируют транскрипционные факторы для структурных генов, другими словами, регулируют уровни их экспрессии [3]. Это очень важная функция,...
-
Жизненный цикл клетки Жизненный цикл-- это время существования клетки от момента ее образования путем деления материнской клетки до собственного деления...
-
Клетки и многоклеточный организм - Клеточная теория
Роль отдельных клеток во многоклеточном организме подвергалась неоднократному обсуждению и критике и претерпела наибольшие изменения. Т. Шванн...
-
Биохимические особенности стареющего организма, Основные механизмы старения - Возрастная биохимия
Основные механизмы старения Биология старения - раздел геронтологии, который изучает старение живых организмов на всех уровнях их организации....
-
В настоящее время проблема адаптации спортсмена к физическим нагрузкам является одной из актуальных проблем. Проблематика заключается в раскрытии...
-
Лизосомы., Митохондрии. - Строение клеток
Лизосомы (от греч. "лизео" - растворяю и "сома" - тело) - это органоиды клетки овальной формы, окруженные однослойной мембраной. В них находится набор...
-
Ауксины - Клетка как осмотическая система. Электрон-транспортная цепь митохондрий. Фитогормоны роста
Ауксины -- это вещества индольной природы. Основным фитогормоном типа ауксина является B -индолилуксусная кислота (ИУК). Открытие ауксинов связано с...
-
Электрон-транспортная цепь локализована на внутренней мембране митохондрий и служит для переноса электронов от восстановленных субстратов на O2 . Процесс...
-
Ядро - самый заметный и самый большой органоид клетки, который первым привлек внимание исследователей. Клеточное ядро открыто в 1831 году шотландским...
-
Строение клетки., Мембрана. - Строение клеток
Клетки находятся в межклеточном веществе, обеспечивающем их механическую прочность, питание и дыхание. Основные части любой клетки - цитоплазма и ядро....
-
Происхождение вирусов и происхождение клетки - Строгие постулаты Коха
Проблема происхождения вирусов - это, по существу проблема независимости генетических элементов в репродуктивном и эволюционном отношении. Основные...
-
Учение о растительной клетке - Учение о растительной клетке
Открытие клетки относится к тому периоду в истории человечества, когда наука впервые решилась сбросить с себя звание Ancillae theologiae (служанки...
-
Транспорт питательных веществ в бактериальную клетку - Физиология микроорганизмов
Пассивный - облегченная диффузия, в следствии разности концентрации питательных веществ, без затрата энергии. Отвечает за транспорт цитоплазматическая...
-
Постсинаптическое торможение - Торможение в ЦНС
Этот вид торможения открыл Д. Экклс (1952) при регистрации потенциалов мотонейронов спинного мозга у кошки во время раздражения мышечных афферентов...
-
Сшивки с белками - Фотохимические превращения ДНК. Люминесцентные метки и зонды
При наличии на поверхности носителя функциональных групп, способных вступать в химические реакции с функциональными группами фермента с образованием...
-
Адаптационные изменения в сердечно-сосудистой системе. Сердце, адаптированное к физической нагрузке, обладает высокой сократительной способностью. Но оно...
-
Заключение - Механизмы адаптации организма человека к двигательной нагрузке
По итогам работы, можно сделать следующие выводы. По данным литературного анализа можно заключить, что адаптация в целом и к физическим нагрузкам в...
-
Библиография - Биологические механизмы жизненного цикла клетки
1. Анатомия и физиология человека: учебник для 9 кл. шк. с углубл. изучением биологии / М. Р. Сапин, З. Г. Брыксина - М.: Просвещение, 1998. - 256 с.,...
-
Основные свойства живых клеток - Цитологические исследования
Изучение живых клеток пролило свет на их жизненно важные функции. Было установлено, что последние можно разбить на четыре категории: подвижность,...
-
Введение, Прокариоты - Прокариотические организмы и их роль в биоценозах
В данном реферате мы рассмотрим прокариотов, как отдельную часть живого мира, так же мы рассмотрим строение прокариотов (бактерий) и их размножение при...
-
Строение бактериальной клетки - Изучение морфологии микроорганизмов
Для изучения строения бактериальной клетки наряду со световым микроскопом применяют электронно-микроскопические и микрохимические исследования,...
-
В большинстве других случаев клеточной пролиферации в период между митозами происходит рост клеток. Клетка увеличивается в объеме почти вдвое и затем...
-
Различные эндокринные расстройства (дисфункции желез внутренней секреции) имеют существенное значение в формировании патологии зубочелюстного аппарата....
-
В настоящее время большое значение в аутоаллергизации организма придается не только тонзилогенным очагам, но и хроническим одонтогенным очагам...
-
Механизм действия гормонов. Роль циклазной системы в механизме действия гормонов - Понятие гормонов
По механизму действия гормоны делят на два основные типа. Первый - это белковые и пептидные гормоны, катехоламины и гормоноиды. Их молекула, подойдя к...
-
Как управлять экспрессией - Технологии изучения клеточных механизмов памяти
Понимание того, каким же образом сигнал, поступающий к клетке, передается на немедленные ранние гены и приводит к их активации, позволяет влиять на их...
-
ВКЛЮЧЕНИЯ РАСТИТЕЛЬНОЙ КЛЕТКИ. ВАКУОЛЬ И КЛЕТОЧНЫЙ СОК - Самостоятельные работы по ботанике. 1 курс
Понятие о вакуоли, функции и возникновения вакуолей. Вакуоли отделены от цитоплазмы тонопластом. Жидкость, заполняющая вакуоль представляет собой...
-
ОБОЛОЧКА РАСТИТЕЛЬНОЙ КЛЕТКИ - Самостоятельные работы по ботанике. 1 курс
Формирование оболочки растительной клетки. Новая оболочка формируется в процессе деления клетки в заключительной стадии митоза - телофазе. После...
-
Обмен белков в организме человека - Строение, функции и значение белков
Важный критерий пищевой ценности белков - доступность аминокислот. Аминокислоты большинства животных белков полностью высвобождаются в процессе...
Механизм некротической гибели клеток (некроза) - Радиационный апоптоз и некроз клеток облученного организма