Как увидеть память - Технологии изучения клеточных механизмов памяти
Итак, экспрессия многих генов зависит от нейронной активности, соответственно, этот феномен получил название активностно-зависимой генной экспрессии. А само его существование означает, что в исследовании памяти можно достичь клеточного разрешения. Нейроны, хранящие память, можно "проявить", то есть провести нейроимиджинг. Для этого сначала нужно создать у экспериментального объекта воспоминание, с которым, собственно, мы будем работать. Классическим объектом является лабораторная мышь. Животное "по просьбе" исследователей приобретает какой-либо опыт: воспринимает, например, незнакомую обстановку, звук или запах. В это время в его мозге активируется некая популяция нейронов. Однако, чтобы этот опыт отложился в памяти, он должен быть достаточно значимым для мыши (ведь и мы запоминаем далеко не все, что с нами происходит). Надежней всего придать ему значение опасности, и классический способ это сделать -- в ходе эпизода опыта ударить мышь слабым электрическим током. И вуаля -- активировавшаяся популяция нейронов гарантированно сохраняет информацию о новых обстановке, звуке или запахе. Эта популяция будет субстратом для имиджинга.
Используем то, что есть
Иммуногистохимический метод имиджинга основан на заповедной иммунореакции антиген--антитело. Срезы мозга животного, убитого вскоре после приобретения памяти, обрабатываем сывороткой, содержащей антитела. В качестве антигена, который они свяжут, выступает белок -- продукт экспрессии немедленного раннего гена. Антитело конъюгировано (соединено) с меткой (флуоресцентной либо с ферментом, после пары манипуляций тоже дающим цветную реакцию), которую будем регистрировать с помощью микроскопа (рис. 1). Между белком-антигеном и меченым антителом обычно "встраивают" несколько видов промежуточных антител -- для усиления чувствительности [13], -- впрочем, сущности метода это не меняет.
Другой метод основан на выявлении мРНК немедленных ранних генов. Конструируются специальные молекулярные зонды, которые при нанесении на исследуемый образец мозга соединяются с мРНК по принципу комплементарности, но кроме того несут собственно метку, по которой мы мРНК обнаружим. Метка может быть флуоресцентной или требовать дополнительной процедуры окрашивания. Описанный метод называетсяFISH (fluorescence in situ hybridization).
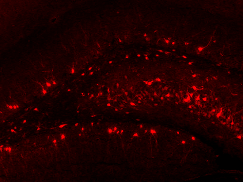
Рисунок 1. Иммуногистохимическое выявление белка Arc в зубчатой извилине крысы. Рисунок из "Википедии"
Он, однако, был доработан специально для целей нейробиологии и приспособлен под выявление в одном образце мозга двух популяций нейронов, активированных двумя различными эпизодами опыта, произошедшими с разницей в небольшой промежуток времени (около 30 минут). Такую модификацию метода назвали cellular compartment analysis of temporal activity by FISH, или простоcatFISH [14]. Сигнал от двух популяций реально идентифицировать благодаря тому, что немедленные ранние гены характеризуются очень мощной экспрессией в момент активации при почти полном фоновом (вне эпизодов нового опыта) "молчании" [3].
Такие метки представляют собой флуоресцентные белки. Об их многообразии и применении в биологических исследованиях рассказывают статьи: "Флуоресцирующая Нобелевская премия по химии" [15], "Флуоресцентные белки: разнообразнее, чем вы думали!" [16], "Флуоресцентные репортеры и их молекулярные репортажи" [17]. -- Ред.
Собственно имиджинг сводится к выявлению в образце двух форм мРНК: ядерной (незрелой), начинающей накапливаться в нейронах через две минуты после активации, и цитоплазматической (зрелой), образующейся из ядерной через 30 минут после активации. Таким образом, по цитоплазматической мРНК мы определяем популяцию клеток, активированную первым эпизодом опыта, а по ядерной -- вторым. Поскольку бомльшая часть ядерной мРНК исчезает, переходя в зрелую цитоплазматическую форму в течение 20 минут после активации клетки, ее сохранение со времен первого эпизода незначительно; ядерная мРНК от второго эпизода и вовсе не успевает перейти в цитоплазматическую форму [14].
В классической методике форму мРНК (ядерная она или цитоплазматическая?) определяют с помощью прямой оценки пространственной локализации (рис. 2), но уже практикуется использование двух зондов, каждый из которых специфичен к одной из форм мРНК и конъюгирован с уникальной меткой. После окрашивания метки дают разный цвет, по которому становится понятна локализация [18, 19].
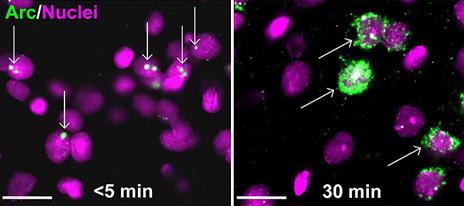
Рисунок 2. Прямая оценка пространственной локализации Arc-мРНК в методе catFISH. Слева -- После активации нейронов Arc-мРНК локализуется в ядре. Справа -- Через 30 минут мРНК перемещается за пределы ядра. Рисунок из [42].
Доделываем то, что нужно
Ст?ит пояснить, что кроме кодирующего участка (экзона) ген имеет и регуляторные, среди которых особенно важен промотор -- участок, ответственный за запуск считывания гена (транскрипции). В случае отсутствия промотора транскрипция не запустится, а вот без "родного" экзона (например, если мы его вырежем и вставим другой) транскрипция будет возможна, причем синтезироваться будет, понятно, продукт, кодируемый вставленным нами экзоном. Эту возможность и используют биологи, подставляя под промоторы немедленных ранних генов то, что им выгодно.
Они получают мышь, несущую в ДНК трансген, в котором под промотором немедленного раннего гена находится экзон тетрациклинового активатора транскрипции, tTA (рис. 3). Продукт экспрессии этого трансгена -- белок tTA -- связывается с тетрациклин-откликающимся элементом (tetO) в составе второго трансгена, имеющегося у мыши, тем самым активируя его транскрипцию [20]. Продукты экспрессии второго трансгена -- это специально разработанная для целей нейробиологии форма фермента в-галактозидазы (tau-LacZ), выступающая в качестве метки [21], а также автономная форма тетрациклинового активатора транскрипции (tTA*). Антибиотик доксициклин (производное тетрациклина) связывает белок tTA и блокирует его активирующее действие на второй трансген.
Устранение же доксициклина приводит к активации трансгена и к синтезу tau-LacZ и tTA*, причем tTA* имеет положительную обратную связь, порождающую перманентное производство tau-LacZ и tTA* даже после возвращения доксициклина в систему. Такие трансгенные мыши всю жизнь держатся на доксициклиновой диете, а во время эксперимента антибиотик отменяется, что позволяет нарабатываться метке [20].
Получается, что именно метка в конечном счете находится под контролем промотора немедленного раннего гена, а вспомогательная система tTA-tetO делает возможным мечение не всех клеток, в которых на протяжении жизни животного сработали немедленные ранние гены, а только тех, в которых они сработали во время нашего эксперимента (то есть сохранивших память о конкретном эпизоде опыта). Проявляется метка посредством цветной ферментативной реакции со своим специфическим субстратом, которым мы обрабатываем образцы мозга. Подобно catFISH, мы можем использовать методику и для выявления двух популяций нейронов, активированных различными эпизодами опыта. Но поскольку метка сохраняется в клетках длительно (из-за автономной активности tTA*), велика верхняя граница времени, на которое могут быть разнесены эпизоды, тогда как в случае catFISH это время может лишь немного отличаться от 30 минут
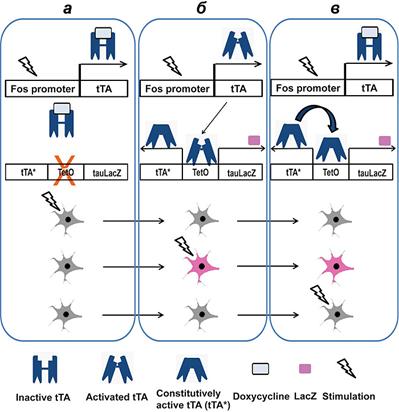
Рисунок 3. Использование трансактивационной системы tTA-tetO для активностно-зависимого мечения нейронов. а -- tTA синтезируется избирательно в нейронах, в которых активировался промотор c-fos. Однако доксициклин связывает tTA и предотвращает его взаимодействие с tetO. б -- После отмены доксициклина tTA от него освобождается и связывается с tetO, индуцируя синтез tau-LacZ и tTA*. в -- После возвращения доксициклина tTA снова инактивируется, но так как tTA* все еще присутствует, он по принципу положительной обратной связи поддерживает активность tetO. Рисунок из [42].
Важно здесь другое: второй эпизод должен произойти непосредственно перед убоем, так как относящуюся к нему популяцию нейронов мы будем выявлять по иммунологическим реакциям с белком немедленных ранних генов*, который, как мы помним, сохраняется кратковременно. Описанная методика двойного выявления носит названиеTetTag (рис. 4).
![выявление двух популяций нейронов в гиппокампе мыши с помощью методики tettag.зеленым окрашен tau-lacz, красным -- белок немедленных ранних генов (слева -- c-fos, справа -- zif268).рисунок из [43]](/images/image004-1566.jpg)
Рисунок 4. Выявление двух популяций нейронов в гиппокампе мыши с помощью методики TetTag. Зеленым окрашен tau-LacZ, красным -- белок немедленных ранних генов (слева -- c-fos, справа -- Zif268).Рисунок из [43].
Давайте теперь посмотрим на другую мышь. У нее есть трансген, в котором под промотором немедленного раннего гена находится экзон тамоксифен-зависимой рекомбиназы Cre (CreERT2), и есть другой трансген, состоящий из синтетического промотора (CAG), экзона красного флуоресцентного белка (tdTomato) и разделяющей их стоп-последовательности, ограниченной с обеих сторон короткими loxP-участками. Активация первого трансгена приводит к синтезу Cre-рекомбиназы. В отсутствие лекарственного вещества тамоксифена этот фермент плавает в цитоплазме, в то время как взаимодействие с тамоксифеном позволяет ему проникать в ядро и производить рекомбинацию. Под рекомбинацией здесь понимается процесс, в ходе которого этот фермент распознает loxP-сайты и вырезает (удаляет) ограниченный ими участок (стоп-последовательность), "разрешая" экспрессию стоящего далее экзона (tdTomato) [22, 23]. Таким образом, если во время эксперимента сделать мыши инъекцию тамоксифена, можно запустить наработку красного флуоресцентного белка, опосредованную активацией немедленного раннего гена. Нейроны, вовлекшиеся в сохранение воспоминания, будут флуоресцировать под действием посылаемого в них микроскопом лазерного луча (рис. 5).
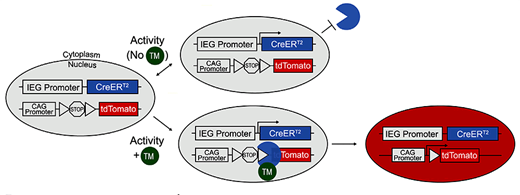
Рисунок 5. Использование рекомбинационной системы Cre/loxP для активностно-зависимого мечения нейронов. Вверху -- Рекомбиназа Cre, произведенная в нейронах с активировавшимся промотором IEG (immediate early gene), без тамоксифена не может попасть в ядро клетки, так что рекомбинации не происходит. Внизу -- Введение тамоксифена вызывает рекомбинацию в активных клетках (тогда как неактивные остаются нетронутыми, потому что и вовсе не экспрессируют ген Cre-рекомбиназы). Запускается наработка красного флуоресцентного белка. Рисунок из [22].
Между прочим, посмотреть выявленную нейронную сеть можно прямо на живом животном! Для этого можно зафиксировать его голову под объективом, а можно использовать специальные регистрирующие модули, закрепляемые на голове свободноподвижных животных и соединяющиеся с массивными элементами микроскопа через оптоволокно (рис. 6). Такие технологии позволяют проводить достаточно длительный мониторинг интенсивности флуоресценции клеток (то есть накопления белка, участвующего в формировании памяти). Флуоресцентная метка сохраняется в клетке если не навсегда, то по крайней мере неопределенно долго, а значит, мы снова можем выявлять популяции нейронов, активированные двумя значительно разнесенными эпизодами опыта. При этом верхняя граница времени их разнесения неопределенно велика, нижняя же зависит от времени наработки метки (для красного флуоресцентного белка примерно три дня)
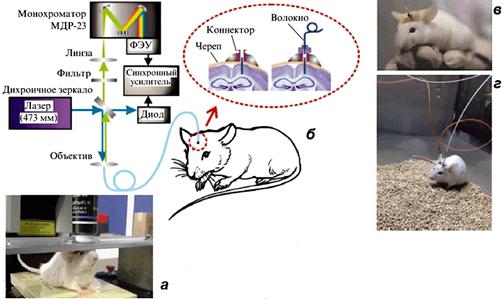
Рисунок 6. Технологии для нейробиологических исследований на живых животных. а -- Стационарный микроскоп. б -- Волоконно-оптический нейроинтерфейс. в -- Мышь со вживленным модулем нейроинтерфейса. г -- Мышь с присоединенной световодной частью. Рисунок из [24].
Сама процедура имплантации регистрирующего модуля в мозг мыши незамысловата. В черепе проделывают дырку диаметром около 1 мм и вводят через нее модуль, закрепляя его цианоакрилатным клеем типа "Момента" (без шуток) и стоматологическим цементом. Оптоволоконный зонд присоединяется к модулю только на время снятия данных, не стесняя жизнедеятельность мышей в остальное время. Такая технология позволяет собирать флуоресцентный сигнал, идущий из глубины в несколько миллиметров, с площади в доли квадратного миллиметра [24, 25], чего вполне достаточно для получения представления о пространственной структуре нейронной сети, учитывая, что большинство нейронов не превосходят в диаметре нескольких десятков микрометров. После имплантации модуля мыши чувствуют себя вполне комфортно и достоверно не отличаются по поведению от мышей, не подвергавшихся процедуре. Модуль долгое время никуда не смещается, позволяя наблюдать за активностью одной и той же группы нейронов в течение нескольких недель [24, 25].
Описанная методика двойного выявления с использованием флуоресцентного белка называется TRAP (targeted recombination in active population). У TRAP есть преимущества перед TetTag, появляющиеся из-за различного характера зависимости систем tTA-tetO и Cre/loxP от фармпрепаратов. Прекращением подачи доксициклина или введением тамоксифена мы активируем систему на определенный отрезок времени. Все нейроны, проявившие активность в пределах этого времени, будут перманентно помечены.
Для системы TetTag чувствительное временн?е окно велико: максимальная экспрессия метки развивается лишь через две недели после прекращения введения доксициклина [22]. Это неудобно и требует дополнительных усилий, чтобы по возможности предотвратить мечение нейронов, активность которых попала в чувствительное временное окно, но не относилась к самому эксперименту.
Для системы TRAP "махинации" с фармпрепаратом позволяют делать окна шириной приблизительно 10 либо 40 часов [22]. В обоих случаях это значительно меньше, чем для системы TetTag, но в то же время достаточно для экспериментов, в которых может требоваться интеграция активности нейронов на протяжении какого-то промежутка времени (рис. 7).
Зачем вообще нужно выявлять две популяции нейронов в одном образце мозга?
Например, мы можем изучать, что происходит с памятью при воспроизведении.
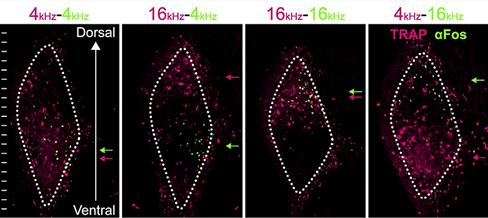
Рисунок 7. Выявление двух популяций нейронов, отвечающих на различные звуковые частоты, в таламусе мыши с помощью методики TRAP. По горизонтали -- различные комбинации звуковых частот. Лиловый цвет представляет собой флуоресценцию трансгенного маркерного белка (tdTomato), зеленым окрашен белок немедленного раннего гена с-fos. Рисунок из [22].
Если в эксперименте в качестве второго эпизода опыта провести напоминание, имиджинг как раз покажет, как изменился вид активирующейся нейронной сети. Знания о том, что происходит с памятью при воспроизведении, предоставляет возможности эффективного вмешательства в нее на этой стадии [26]. Например, возможность ослабления травмирующих воспоминаний. У животных эти воспоминания получается стереть напрочь, вводя на стадии воспроизведения ингибиторы синтеза белка [5], хотя подвергнуть такому человека было бы как-то дико (рис. 8).
Не менее важные результаты приносит выявление в одном образце мозга популяций нейронов, хранящих различные воспоминания. Их перекрытие на поведенческим уровне проявляется формированием у животного ассоциативной связи, то есть мы можем изучать молекулярные механизмы обучения.

Рисунок 8. Кадр из фильма "Вечное сияние чистого разума". Рисунок взят с сайтаhttps://www. pinterest. com.
Похожие статьи
-
Как управлять экспрессией - Технологии изучения клеточных механизмов памяти
Понимание того, каким же образом сигнал, поступающий к клетке, передается на немедленные ранние гены и приводит к их активации, позволяет влиять на их...
-
Как управлять памятью - Технологии изучения клеточных механизмов памяти
Что, если создать трансгенных мышей, у которых, как и у уже рассмотренных, промотор немедленных ранних генов находится под контролем системы tTA-tetO или...
-
Чем занимаются немедленные ранние гены в клетке? - Технологии изучения клеточных механизмов памяти
Некоторые из них кодируют транскрипционные факторы для структурных генов, другими словами, регулируют уровни их экспрессии [3]. Это очень важная функция,...
-
Если возбуждение нейронов, активировавшихся при восприятии нами информации из внешней среды, поддерживается длительно, то сигнал доходит до их ядер и...
-
Технологии изучения клеточных механизмов памяти - Технологии изучения клеточных механизмов памяти
Автор: Субботина А. Фундамент учения дуализма серьезно пошатнулся еще во второй половине XIX века наблюдением за отклонениями психической деятельности у...
-
Литература - Технологии изучения клеточных механизмов памяти
1. Han J. H., Kushner S. A., Yiu A. P., Cole C. J., Matynia A., Brown R. A. et al. (2007). Neuronal competition and selection during memory formation....
-
Физиологические механизмы памяти - Биосоциальная сущность человека
Для адаптации индивидуального поведения к окружающей среде, тем более для осуществления разнообразной высшей нервной деятельности, человеку, равно как и...
-
В сфере научных интересов сразу несколько направлений. Во-первых, применение стволовых клеток пуповинной крови и костного мозга при нейродегенеративных...
-
Молекулярные механизмы регуляции клеточной смерти - Биологические механизмы жизненного цикла клетки
Апоптоз - многоэтапный процесс. Первый этап - прием сигнала, предвестника гибели в виде информации, поступающей к клетке извне или возникающей в недрах...
-
Виды клеточной смерти - Биологические механизмы жизненного цикла клетки
Гибель (смерть) отдельных клеток или целых их групп постоянно встречается у многоклеточных организмов, также как гибель одноклеточных организмов. Причины...
-
Мышечная дистрофия - одно из самых тяжелых заболеваний опронодвигательного аппарата. В настоящее время нет лекарства на основе стволовых клеток для...
-
ВИДЫ БИОЛОГИЧЕСКОЙ ПАМЯТИ. - Память
Биологическая память - это фундаментальное свойство живой материи приобретать, сохранять и воспроизводить информацию. Различают три вида биологической...
-
Механизмы апоптоза - Радиационный апоптоз и некроз клеток облученного организма
Развитие и функционирование многоклеточных организмов подразумевает равновесие между синтезом и распадом молекул, их окислением и восстановлением,...
-
Биологические виды, Изоляция и видообразование - Механизмы эволюции
Вплоть до XVII в. исследователи опирались на представление о виде, созданное еще Аристотелем, который воспринимал виды как совокупности сходных особей....
-
В аспекте спортивной педагогики функциональное состояние - комплекс свойств, определяющий уровень жизнедеятельности организма, системный ответ организма...
-
Функция мозжечка заключается в контроле над всеми видами движений. Он "программирует" координацию многочисленных отдельных движений, составляющих один...
-
Механизмы генетической инактивации - Эффект положения гена
Почему при перенесении гена в окружение гетерохроматина происходит компактизация участка хромосомы и как следствие инактивация гена? Наиболее разумными...
-
Органы-мишени и механизм действия инсулина - Биохимия поджелудочной железы
1. В крови инсулин может быть в двух формах: свободной и связной. Органы - мишени свободного инсулина: печень, скелетная мускулатура, кишечник; связного...
-
Генетические методы изучения биопленок - Использование микробных биопленок в промышленности
Для выявления генов, участвующих в генетическом контроле любого процесса, используются методы направленного и ненаправленного (инсерционного)...
-
Грибы - обширная группа организмов, насчитывающая около 100 тысяч видов. Данное царство встречается в самых разнообразных местообитаниях: воде, почве, на...
-
Основные методы, которые были использованы при исследовании видов рода Amanita Fr. - это среднемасштабный маршрутный метод исследования микобиоты и...
-
Клетка от клетки - Клеточная теория
Формулировка положения "Всякая клетка от клетки" связана с именем знаменитого ученого Р. Вирхова. Т. Шванн в своих обобщениях подчеркивал одинаковость...
-
Клетка - единая система сопряженных функциональных единиц - Клеточная теория
В начале нашего изложения в согласии с клеточной теорией мы обсуждали первый ее постулат: клетка - наименьшая единица живого. Однако мы знаем о сложности...
-
Методы культивирования биопленок В последнее десятилетие произошло значительное расширение возможности изучения формирования микробных биопленок....
-
Наиболее важной буферной системой плазмы является бикарбонатный буфер, состоящий из слабой угольной кислоты (рК1 6,1) и ее кислого аниона бикарбоната....
-
Память человека и аналогия в информатике
К информационному толкованию "жизненной силы" наиболее приблизились виталисты, которых нещадно критиковали те, кто позже объявил генетику и кибернетику...
-
Основные способы приготовления обыкновенных пластырей - Технология производства пластырей
Чтобы получить хороший пластырь, все его ингредиенты должны быть лучшего качества, чистыми и сухими (без воды). Если в каких-либо составных частях,...
-
Механизм экзоцитоза медиатора - Нервно-мышечная физиология
Для экзоцитоза необходимы ионы кальция, которые входят в терминаль через кальциевые каналы и белки экзоцитоза. Среди них синаптотагмин, синаптобревин,...
-
Понятие и классификация пластырей - Технология производства пластырей
Пластырями называют препараты, применяемые исключительно наружно и отпускаемые или в виде массы, намазанной тонким слоем на коленкор, полотно, шелк,...
-
Общие методы изучения вирусов - Строгие постулаты Коха
О присутствии вируса в организме как при спонтанном заболевании, так и при экспериментальном заражении хозяина судят по появлению тех или иных...
-
Для расчета контраста изображений кристаллических тел, имеющих регулярные структуры, а также для решения обратной задачи -- расчета структуры объекта по...
-
Поляризационная микроскопия, Метод фазового контраста - Методы изучения клетки
Поляризационная микроскопия - это метод наблюдения в поляризованном свете для микроскопического исследования препаратов, включающих оптически...
-
Кора головного мозга. - Память
В хранении долговременной памяти участвует большая часть коры. Ввиду своей сложности кора головного мозга с трудом поддается исследованию. Поскольку у...
-
Жизненный цикл клетки - Биологические механизмы жизненного цикла клетки
Биологический клетка деление До сих пор много тайн клетки остаются неразгаданными. Загадочным во многом остается и запрограммированный генетически...
-
Клеточная теория - Цитологические исследования
Клетки - это структурные единицы организмов. Впервые этот термин употребил Роберт Гук в 1665 году. К XIX веку усилиями многих ученых (особенно Маттиаса...
-
Элонгация - Молекулярный механизм репликации ДНК
Репликация ДНК осуществляется ДНК-зависимыми ДНК-полимеразами. Данный фермент обладает некоторыми свойствами: 1. Фермент не может начинать синтез. Он не...
-
Терминация - Молекулярный механизм репликации ДНК
После завершения репликации хромосомы 5'-концы дочерних цепей ДНК недостроены, так как после удаления праймеров эти фрагменты оказываются...
-
В каждом организме (животном, растительном или микробной клетке) все время происходят сложные процессы превращения веществ. Велика роль в этих процессах...
-
Микроскопический метод исследования предусматривает наблюдение за живыми и убитыми микробами в окрашенном и неокрашенном состоянии. Различают простые и...
-
Цитологические данные, полученные при изучении вирусных инфекций - Строгие постулаты Коха
В течение долгого времени считали, что репликация ВТМ происходит только в цитоплазме. Однако некоторые данные, полученные при цитологических и...
Как увидеть память - Технологии изучения клеточных механизмов памяти