ХИМИЯ ЭЛЕМЕНТОВ VI ГРУППЫ, Кислород - Химия элементов VI группы
16-ю группу периодической таблицы химических элементов Д. И. Менделеева составляют Халькогемны (от греч. чблкпт -- медь (в широком смысле), руда (в узком смысле) и генпт -- рождающий). Это такие химические элементы, как кислород (O), сера (S), селен (Se), теллур (Te), радиоактивный полоний (Po), и искусственно полученный ливерморий (Lv). Все эти элементы встречаются в природе (за исключением Lv), причем каждый из них имеет несколько природных изотопов (за исключением Po). Все они являются р-элементами. Строение валентного уровня их электронных оболочек соответствует формуле Ns2Np4.
Кислород сера селен теллур полоний
Кислород

Самый распространенный элемент на Земле: в воздухе - 21% по объему (находится в виде О2 и О3), в земной коре - 49 % по массе, в гидросфере - 89% по массе, в составе живых организмов - до 65% по массе. В земной коре он содержится в виде различных минералов, которые представляют собой оксиды (например, Al2O3, SiO2, Cu2O, SnO2) и соли (например, FeCO3, CaSO4, Ca3(PO4)2).
Атом
Порядковый № 8, электронное строение: 1s22s22p4
Валентность
II, в СО - валентность III за счет ДАС.
Степени окисления
- 1) -2 - оксиды, гидроксиды, соли; 2) -1 - пероксиды; 3) -1/2, -1/3 - надпероксиды, озониды; 4) +2 - ОF2, +1 - O2F2.
Электроотрицательность
ЭО = 3,5.
Изотопы природного кислорода
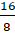
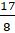
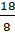
О (99,76%), О (0,04%), О (0,20%).
Физические свойства
Кислород - газ без цвета, запаха и вкуса, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород - голубоватая жидкость, кипящая при -1830С. Притягивается магнитом. Твердый кислород - синие кристаллы, плавящиеся при -218,70С.
Строение молекулы
Молекула состоит из двух атомов, связанных двойной связью. Связь - ковалентная неполярная.
Аллотропные модификации (изменения)
О2 и О3 (озон).
Способы получения
- 1) Промышленный способ: перегонка жидкого воздуха; 2) Лабораторный способ: разложение (воздействие t0C) некоторых кислородсодержащих веществ 2KMnO4 = K2MnO4 + MnO2 + O2 2KClO3 = 2KCl + 3O2 (k - MnO2) 2H2O2 = 2H2O + O2 (k - MnO2) 2HgO = 2Hg + O2 2KNO3 = 2KNO2 + O2
Способы собирания кислорода

Химические свойства
1) Взаимодействие с НеMet (кроме фтора и благородных газов): образуются ОКСИДЫ - бинарные соединения с кислородом в степени окисления -2:
Si + O2 = SiO2 (t=400-5000С)
- При взаимодействии с углеродом, фосфором и мышьяком в зависимости от количества кислорода образуются разные оксиды:
С + О2(изб) = СО2; С + О2(нед) = СО
- - При взаимодействии с серой последняя окисляется до сернистого газа (дальнейшее воздействие кислородом приводит к образованию высшего оксида - SO3):
- S + O2 = SO2
- 2F2 + O2 = 2OF2 2) Взаимодействие с Met: образуются основные и амфотерные оксиды: 4Al + 3O2 = 2AL2O3
Na + O2 = Na2O2
- При взаимодействии с калием, рубидием и цезием образуются надпероксиды:
K + O2 = KO2
- - При взаимодействии с железом образуется смесь оксидов:
- 3Fe + 2O2 = Fe3O4 (Fe2O3*FeO)
Mn + O2 = MnO2
- 3) Взаимодействие со сложными веществами:
- - Горение и обжиг сульфидов, водородных соединений:
CH4 + 2O2 = CO2 + 2H2O
- Окисление низших оксидов до высших:
FeO + O2 = Fe2O3
CO + O2 = CO2
- - Окисление гидроксидов и солей в водных растворах: если вещество неустойчиво на воздухе:
- 2HNO2 + O2 = 2HNO3 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Аммиака: NH3 + O2 = NO + H2O
Органических веществ: C2H5OH + O2 = CH3-COH и т. п. (k - Cu; t0C)
Применение кислорода
Кислород применяют в медицине, на взрывных работах, для сварки металлов, для резки металлов, в авиации для дыхания, в авиации для двигателей, в металлургии.
Содержащийся в атмосфере кислород расходуется в процессе дыхания человека, животных и растений. В процессе хозяйственной деятельности человека кислород расходуется в больших количествах, например при сжигании различных видов топлива (природного газа, метана, угля, древесины):
CH4 + 2O2 = CO2 + 2H2O
C + O2 = CO2
C6H10O5 + 6O2 = 5CO2 + 6H2O
Во всех этих процессах образуется оксид углерода (IV). Единственный естественный природный процесс связывания оксида углерода (IV) - процесс фотосинтеза, проходящий в зеленых растениях под действие солнечного света:
6CO2 + 6H2O = C5H12O6 + O2 (k - hv)
При этом образуется глюкоза - основа для строительства тканей растений.
Если какое-либо вещество медленно реагирует с кислородом, то такое окисление называют медленным. Это, например, процессы разложения пищевых продуктов, гниения.
Озон
Озон - это аллотропная модификация кислорода.
Физические свойства
Газ, с запахом свежей хвои, бесцветен.
Получение
- 1) Озонирование воздуха: 3O22O3 2) Во время грозы (в природе); 3) В лаборатории - в озонаторе.
Химические свойства
- 1) Неустойчив, легко распадается: O3O2 + O.. При этом образуется АТОМАРНЫЙ кислород, очень сильный окислитель. Он обесцвечивает красящие вещества, отражает УФ-лучи, уничтожает микроорганизмы; 2) Сильный окислитель, сильнее кислорода: 6NO2 + O3 = 3N2O5 3PbS + 4O3 = 3PbSO4 3) Качественная реакция на озон: реакция с йодидом калия, появляется желто-коричневая окраска йода: 2KI + O3 = 2KOH + I2 + O2
Пероксид водорода
Стоит уделить особое внимание этому веществу, так как из всех соединений кислорода именно пероксид водорода чаще всего используют как стерилизационное и антисептическое средство.
Строение молекулы
Н2О2 или Н-О-О-Н
Физические свойства
Это бесцветная неустойчивая жидкость. Плотность составляет 1,45 г/см3. Ее концентрированный раствор (30%) взрывоопасен и называется пергидролем.
Получение
Гидролиз пероксидов металлов водой или кислотами:
BaO2 + H2SO4 = H2O2 + BaSO4
Химические свойства
- 1) Разложение: 2H2O2 = 2H2O + O2 (t0C, k - MnO2) 2) Пероксид водорода может быть как окислителем, так и восстановителем:
- - Окислительные свойства более характерны - переходит в Н2О или ОН-:
Na2S+4O3 + H2O2 = Na2S+6O4 + Н2О
- (неметаллы в промежуточной степени окисления окисляет в высшую степень окисления) 2Fe(OH)2 + H2O2 = 2Fe(OH)3 2KI + H2O2 + H2SO4 = I2 + K2SO4 + 2H2O
PbS + 4H2O2 = PbSO4 + 4H2O
- (сульфиды переходят в сульфаты) 2Cr+3Cl3 + 3H2O2 + 10KOH = 2K2Cr+6O4 + 6KCl + 8H20 (любые соединения хрома +3 окисляет в +6) - Восстановительные свойства - переходит в О2:
CaOCl2 + H2O2 = CaCl2 + O2 + H2O
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
K2Cr2O7 + 3H2O2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3O2 + 7H2O
Пероксиды и надпероксиды металлов
Химические свойства этих соединений имеют свою особенность: в ОВР, а также в реакциях разложения водой образуется кислород:
Химические свойства
1) Разложение водой:
Na2O2 + H2O = H2O2 + NaOH
K2O2 + H2O = H2O2 + O2 + KOH (при t0C)
2) Они являются сильными окислителями:
KO2 + Al = KAlO2
- 3) В некоторых реакциях проявляют восстановительные свойства: 2KMnO4 + 5Na2O2 + 8H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 5O2 + 8H2O 4) Взаимодействуют с углекислым газом:
Na2O2 + CO2 = Na2CO3 + O2
Получение
1) Me (щелочные и Ва) + кислород:
Na + O2 = Na2O2
K + O2 = KO2
- 2) Оксиды металлов + кислород: 2K2O + 3O2 = 4KO2
Похожие статьи
-
Теллур - Химия элементов VI группы
Теллур -- химический элемент 16-й группы, 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium) . Атом...
-
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
По химическим свойствам галлий сходен с алюминием. На воздухе Ga покрывается оксидной пленкой, предохраняющей от дальнейшего окисления. С мышьяком,...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Полоний - Химия элементов VI группы
Полоний - радиоактивный химический элемент 16-й группы, 6-го периода в периодической системе Д. И. Менделеева, с атомным номером 84, обозначается...
-
ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Легкий, мягкий, быстро окисляющийся металл серебристо-белого цвета Алюминий -- очень активный металл. В ряду напряжений он стоит после щелочных и...
-
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЭЛЕМЕНТОВ VI ГРУППЫ, Кислород - Химия элементов VI группы
Кислород Биологическая роль кислорода Основной (фактически единственной) функцией кислорода является его участие как окислителя в...
-
Ливерморий - Химия элементов VI группы
Ливермомрий (лат. Livermorium, Lv), ранее был известен как унунгемксий (лат. Ununhexium, Uuh) и эка-полоний -- 116-й химический элемент, относится к 16-й...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
ХИМИЧЕСКИЕ СВОЙСТВА БОРА. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Твердый, хрупкий, блестяще-черный полуметалл. Химически бор при обычных условиях довольно инертен взаимодействует активно лишь с фтором, причем...
-
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Мягкий металл синевато-белого цвета Конфигурация внешней электронной оболочки атома Tl 6s26р1; в соединениях имеет степень окисления +1 [Tl (I)] и +3 [Tl...
-
Гальванический элемент. ЭДС гальванического элемента - Основы химии
Рассмотрим простейший гальванический элемент Даниэля - Якоби, состоящий из двух полуэлементов - цинковой и медной пластин, помещенных в растворы...
-
Подгруппа бора -- главная подгруппа III группы. По новой классификации ИЮПАК: 13 группа элементов Периодической системы химических элементов Д. И....
-
Кислород: история открытия и основные свойства
Кислород - элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8....
-
ХИМИЧЕСКИЕ СВОЙСТВА ИНДИЯ. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
В соответствии с электронной конфигурацией атома 4d105s255p1 индий в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом...
-
Зарождение современной химии, Теория флогистона и система Лавуазье - Химия сегодня
Представления древнегреческих натурфилософов оставались основными идейными истоками естествознания вплоть до XVIII в. До начала эпохи Возрождения в науке...
-
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 путем разложения оксида ртути в герметично закрытом...
-
Периодический закон химических элементов: свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической...
-
Электронное строение элементов главной подгруппы III группы - Третья группа периодической системы
Ат. номер Название и символ Электроннаяконфигурация 5 Бор В [Не]2s22р1 13 Алюминий Аl [Nе]3s2Зр1 31 Галлий Gа [Аr]3d104s24р1 49 Индий In [Кr]4d105s25р1...
-
ВЫВОД - Химические элементы главной подгруппы III группы
С увеличением атомной массы усиливается металлический характер элементов. Бор -- неметалл, остальные элементы - типичные металлы. Бор значительно...
-
Теллур, Полоний - Химия элементов VI группы
Биологическая роль теллура Микроколичества теллура всегда содержатся в живых организмах, его биологическая роль не выяснена Влияние на организм...
-
Сера - Химия элементов VI группы
Биологическая роль серы Как и элементы органогены, сера в виде отдельного элемента не обладает биологическим значением. Ее биологическая роль состоит в...
-
Способы получения и химические свойства оксидов - Основы химии
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Окисление кислородом простых...
-
Химические свойства Галлия. - Третья группа периодической системы
На воздухе при обычной температуре Галлий стоек. Выше 260° С в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной...
-
Средства для окраски волос - Химия в косметике
В быту в качестве дезинфицирующего и отбеливающего средства широко используют растворы (3, 6, 10 %-ные) пероксида водорода. Более концентрированный --...
-
Здесь следует подчеркнуть, что вторичной переработке могут быть подвергнуты только ТПО из термопластичных синтетических материалов, т. е. материалов,...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА - Неограническая химия
Задание 3.1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте...
-
Химия 20 века - Этапы становления химии
Конец 19 в. ознаменовался тремя выдающимися открытиями в области физики, в результате которых была доказана сложная структура атома, прежде считавшегося...
-
Бор в организме - Третья группа периодической системы
. Бор относится к числу химических элементов, которые в очень малых количествах содержатся в тканях растений и животных (тысячные и десятитысячные доли%...
-
Физические свойства., Химические свойства. - Третья группа периодической системы
Алюминий в свободном виде -- серебристо-белый металл, обладающий высокой тепло - и электропроводностью. Алюминий имеет невысокую плотность -- примерно...
-
Химические свойства Алюминия. - Третья группа периодической системы
Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1. В обычных условиях Алюминий в соединениях 3-валентен, но при...
-
Теория Периодической Системы была преимущественно создана Н. Бором (1913-21) на базе предложенной им квантовой модели атома. Учитывая специфику изменения...
-
Сушки (температура материала 100...200 °C - здесь происходит частичное испарение воды); подогрева (200...650 °C - выгорают органические примеси и...
-
Соединение Магния., Неорганические соединения магния. - Химический элемент Магний
Для аналитической химии магния имеют значение его труднорастворимые и особенно внутрикомплексные (бесцветные, окрашенные или флуорисцирующие) соединения....
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Роберт Боиль - Становление понятия о химическом элементе
Боиль жил в эпоху великих общественных и духовных преобразований. Однако несмотря на сильные религиозные тенденции, Бойль научными работами расчистил...
-
С кислородом большинство металлов образует оксиды - амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития,...
-
Химическая технология и тенденции ее развития - Этапы становления химии
Потребности общества породили химическую технологию. По выражению Бертло, химия начинает творить свой собственный объект исследования, создавая сотни...
-
Физические свойства Таллия - Третья группа периодической системы
. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет...
-
Труды по химии и фармации - Карл Шееле, значение его работ для фармации
Карл Шелле был очень любознательным и целеустремленным человеком, и, не смотря на то, что он не смог получить высшего образования, его волевой характер и...
ХИМИЯ ЭЛЕМЕНТОВ VI ГРУППЫ, Кислород - Химия элементов VI группы