Галогениды урана, Фториды урана - Уран и его соединения
Галогениды урана - большой и важный класс соединений; они играют важную роль в реализации программ по атомной энергетике. Так, гексафторид урана используется в крупномасштабном разделении изотопов 235U и 238U; тетрахлорид урана играл аналогичную роль в крупномасштабном разделении этих изотопов электромагнитным методом. Тетрафторид урана является исходным соединением для получения металлического урана и гексафторида урана; тетрахлорид также входит как один из компонентов в состав топлива атомного реактора на расплавах солей.
Фториды урана
Получено шесть фторидов урана, из которых UF3, U4F17, U2F9 и UF4 считаются нелетучими, а UF6 летучим. Важнейшими из фторидов являются я UF4 и UF6.
Гексафторид урана был открыт Раффом и Хайнзельманом. Фторид урана (VI), UF6, образуется при различных реакциях, которые можно разделить на три группы: а) реакции с элементным фтором; б) реакции с использованием фторирующих веществ (фторидов галогенов, высших фторидов металлов); в) реакции, в которых не используются F2 или фторирующие вещества.
UО 3, U3О 8, UO2 или UF4 можно профторировать непосредственно фтором. Если пропустить струю фтора над лодочкой, содержащей исходное вещество, то при навесках в несколько десятков граммов выход продукта будет низким по двум причинам: 1) препарат спекается из-за повышения температуры на поверхности вещества в ходе реакции; 2) он покрывается слоем промежуточных легкоплавких фторидов UF5, U2F9 и U4F17. Поэтому для таких навеcок используют синтез в кипящем слое, для которого особенно пригоден UF4.
Фторирование оксида урана протекает по реакции:
UO2 (1/3U3O8; UO3) + 3F2 = UF6 + nO2 (t>500°С, 370°С,400°С)
Реакция в кипящем слое осуществляется по уравнению:
UF4 + F2 >UF6
Или U3O8+ 9F2 = 3UF6 + 4O2
Для лабораторных целей удобно фторирование фторидом кобальта (III): UF4 + 2CoF3 >UF6 + 2CoF2
Есть методы синтеза, в которых не используются фтор и сильные фторирующие средства, но выходы в них значительно ниже. Примером является реакция: 2UF4 +O2 >UO2F2 +UF6
UF6 - бесцветные (серые) кристаллы с высоким коэффициентом преломления. Летучее соединение. Твозг= 56,5 °С; Тпл=64,5-64,8° (под давлением). Кристаллическая структура ромбическая. UF6 чрезвычайно чувствителен к влаге, энергично реагирует с Н 2О с образованием UO2F2 и HF, а также с большим числом органических веществ и растворителей. Взаимодействует с большинством металлов, что осложняет способы его хранения. В качестве материалов сосудов для работы с UF6 пригодны: при нагревании Ni, монель и Pt, на холоду - еще и тефлон, абсолютно сухие кварц и стекло, медь и алюминий. UF6 бурно реагирует с алюминием с образованием тонкого слоя AlF3, который блокирует дальнейшую реакцию. При температурах 25-100°С образует комплексные соединения с фторидами щелочных металлов и серебра типа 3NaF?UF6, 3KF?2UF6.
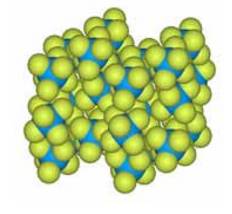
Рис. 2 Кристаллическая структура гексафторида урана.
Кристаллическая структура гексафторида урана построена из правильных симметричных октаэдров. Рентгеновскими методами показано, что кристаллическая структура UF6 представляет собой типичную молекулярную решетку. Поведение UF6 близко к поведению идеального газа.
Элементы главной группы, твердые при комнатной температуре (например, щелочноземельные металлы, B, Al, Ga, In, C, Si, Ge, Sn, Pb, As, Sb, S, Se и Tc) взаимодействуют с UF6, образуя фториды, обычно высшие. Низшие фториды, например, PF3, SF4, MoF5 или WF4 могут фторироваться до высших. Низшие оксиды превращаются в оксид-фториды.
При работе с UF6 необходимо обращать внимание, что это - весьма токсичное вещество. С углеводородами и другими органическими веществами UF6 энергично реагирует, поэтому закрытые сосуды с UF6 могут взрываться. Нужно избегать попадания UF6 на кожу или другие ткани тела, так как образующийся при этом вследствие гидролиза фтороводород вызывает тяжелые ожоги, которые отягчаются дополнительным воздействием урана. UF6 реагирует с влагой воздуха с образованием тумана ядовитых UO2F2 и HF, поэтому надо особо остерегаться вдыхания паров UF6. Работу следует всегда проводить в закрытых системах, держать в готовности маски с фильтрами, защищающими от газообразных кислот.
UF5 существует в виде двух модификаций: б - (высокотемпературная) и в - (низкотемпературная). Температура перехода б>в составляет 125°.
Простой способ основан на взаимодействии UCl6 или UCl5 с безводным HF:
UCl5 (UCl6) + 5HF = UF5 + 5HCl (+1/2 Cl2)
Может быть использовано сопропорционирование UF4 и UF6:
UF4 +UF6 >2UF5
Б-UF5 - вещество серовато-белого цвета. Кристаллическая структура тетрагональная. В вакууме выше 500° возгоняется, при 150° начинает диспропорционировать. Тпл=348° (под давлением UF6).
В-UF5 - вещество бледно-желтого цвета. Кристаллическая структура тетрагональная.
Фторид урана UF4 ("зеленая соль") - одно из важнейших соединений урана. Фторид урана (IV) является промежуточным продуктом при получении как UF6, так и металлического урана.
UF4 можно получить по реакциям:
UO2 + 4HF >UF4 + 2H2O
UO3 + 2CCl2F2 >UF4 +Cl2 +COCl2 +CO2
UF4 - порошок от голубовато-зеленоватого до изумрудного цвета. Сублимацией в вакууме 10-6 мм рт. ст. при 1000° в молибденовой трубке получают темно-зеленые кристаллы. Тпл=960°; Ткип= ~1417°. Кристаллическая структура моноклинная. В химическом отношении UF4 является устойчивым, довольно неактивным соединением. В кислотах-окислителях растворяется с образованием соли уранила; быстро растворяется в горячем растворе Al(NO3)3 или AlCl3, а также в растворе борной кислоты, подкисленной H2SO4, HClO4 или HCl. С фторидами других металлов образует ряд малорастворимых двойных солей (MeUF6, Me2UF6, Me3UF7 и др.). [6]
UF4 + 4NaOH(конц) = U(OH)4 + 4NaF
UF4 + 2M = U + 2MF2 M=(Mg, Ca)
UF4 * 2.5H2O = UF4 * H2O + 1.5 H2O (100°С) [9]
Фторид урана (III) UF3 можно получить по реакциям:
UF4 + Al = UF3 + AlF (900°С)
3UF4 +U >4UF3
UF3 - черная, кристаллическая, похожая на кокс масса, в которой под микроскопом можно увидеть мелкие темно-красно-фиолетовые кристаллы. При нагревании выше 1200° диспропорционирует на UF4 и U. Кристаллическая структура гексагональная.
Похожие статьи
-
Физические свойства урана, Химические свойства урана - Уран и его соединения
Металлический уран в чистом виде представляет собой плотный блестящий металл серебристого цвета, на воздухе покрывающийся тонкой пленкой оксида....
-
Получение урана. - Уран и его соединения
Способов выделения урана из руд разработано великое множество. Причиной тому, с одной стороны, стратегическая важность элемента №92, с другой -...
-
Соединения урана. Гидриды урана - Уран и его соединения
Металлический уран, нагретый до 250 °С - 300 °С реагирует с водородом образуя гидриды урана. При более высоких температурах гидрид урана обратимо отдает...
-
Соединения Pt (VI) - Платина и ее соединения
Все изученные окислы платины термически неустойчивы, но очевидно, что чем выше проявляемая платиной в окислах степень окисления, тем сильнее выражен...
-
История открытия урана - Уран и его соединения
Первая важная дата в истории урана - 1789 г., когда немецкий натурфилософ и химик Мартин Генрих Клапрот восстановил извлеченную из саксонской смоляной...
-
Молекулярные кристаллы фуллеренов -- полупроводники, однако в начале 1991 г. было установлено, что легирование твердого С60 небольшим количеством...
-
Реакции с механизмом SN1 для ароматических соединений встречаются крайне редко и, по сути, характерны только для солей диазония. Эти реакции идут в...
-
Месторождения и распространенность в природе - Уран и его соединения
Общие сведения. В ходе масштабных научных и геологических исследований второй половины XX в. установлено, что уран в природе достаточно распространен. По...
-
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация....
-
Введение - Уран и его соединения
Уран (устаревший вариант ураний) - химический элемент с атомным номером 92 в периодической системе, атомная масса 238,029; относится к семейству...
-
Свойства и важнейшие характеристики. - Полимерные соединения
Линейные полимеры обладают специфическим комплексом физико-химических и механических свойств. Важнейшие из этих свойств: способность образовывать...
-
АНАЛИТИКА Компиляция выдержек из различных источников - удельная б-активность U235 и U238 составляет соответственно 0,08 и 0,012 Бк/мкг (или 80 и 12...
-
Химические свойства алюминия и его соединений - Алюминий и его свойства
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид). I. Взаимодействие с простыми...
-
Важнейшие строительные материалы и их соединения - Химия в строительстве
Большинство строительных материалов представляют собой смеси разнообразных химических соединений, которые, в свою очередь, состоят из химических...
-
Вещество [Co] Лиганды и Комплексообразователь Координационное число 6 Для комплексов с координационным числом 6 характерно октаэдрическое расположение...
-
Магнийорганические соединения. - Химический элемент Магний
Соединения магния с органическими кислотами. Ацетат магния Mg(CH3COO)2 - хорошо растворимое в воде соединение. Оксалат магния MgC2O4 - труднорастворимое...
-
ВВЕДЕНИЕ - Свойства кобальта и его комплексных соединений
Соединения кобальта представляют особый интерес, так как из трех основных ферромагнитных металлов - железа, никеля и кобальта - последний обладает...
-
Ионные уравнения - Классы неорганических соединений
В растворах электролитов реакции происходят между гидратированными ионами, поэтому их называют ионными реакциями. В направлении их важное значение имеют...
-
Соединения Pt (IV) - Платина и ее соединения
Степень окисления +4 характерна для платины. Для Pt (IV) известны коричневые (разных оттенков) оксид PtO2, гидроксид Pt(OH)4 (правильнее PtO2*nH2O),...
-
Токсикодинамика (от токсико... и греч... dynamis -- сила) динамика отравления, вызываемого ядом; процесс отравления, его развитие. Термин употребляется...
-
Катализаторы При алкилировании ароматических углеводородов (бензол, толуол и др.) хлорпроизводными в промышленности в качестве катализатора используют...
-
Применение кобальта и его комплексных соединений - Свойства кобальта и его комплексных соединений
Кобальт в виде порошка используют в основном в качестве добавки к сталям. При этом повышается жаропрочность стали, улучшаются ее механические свойства...
-
ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. - Галлий
Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ножом) металл превратился в...
-
Основные классы неорганических соединений
Классификация неорганических веществ прошла долгий путь развития и складывалась постепенно, начиная с первых опытов алхимиков, вплоть до наших дней,...
-
Водородные соединения, Водородная связь - Свойства водорода
В этой таблице слева легкой тенью выделены клетки элементов, образующих с водородом ионные соединения - гидриды. Эти вещества имеют в своем составе...
-
СИНТЕЗ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ - Пластические массы и изделия на их основе
Природные (естественные) органические высокомолекулярные соединения образуются в процессе биосинтеза в клетках растений и живых организмов и для...
-
Соединение Магния., Неорганические соединения магния. - Химический элемент Магний
Для аналитической химии магния имеют значение его труднорастворимые и особенно внутрикомплексные (бесцветные, окрашенные или флуорисцирующие) соединения....
-
Кислоты и их соли - Фосфор и его соединения
А) Фосфористая кислотаH3PO3. Безводная фосфористая кислота Н3РО3образует кристаллы плотностью 1,65 г/см3, плавящиеся при 74°С. Структурная формула: При...
-
Кислота из гипса - Сера и ее соединения
Если сульфидов металлов мало (как, например, в ГДР), то исходными продуктами для получения серной кислоты могут служить ангидрит CaSO4 и гипс СаSO4*2Н2О....
-
Осторожно! Яд! - Сера и ее соединения
Как известно, в природе сера часто встречается в соединениях с металлами в форме сульфидов металлов. Широко используемый в лабораториях сульфид железа...
-
Кислородсодержащие соединения нефти представлены карбоновыми кислотами различного строения, смолистыми соединениями. К ним следует отнести и воду,...
-
Введение, Соединения фосфора, Оксиды - Фосфор и его соединения
Пятая группа Периодической системы включает два типических элемента азот и фосфор - и подгруппы мышьяка и ванадия. Между первым и вторым типическими...
-
Галогениды германия - Свойства германия
Кремний и германий образуют галогениды состава Э(Hal)4 со всеми галогенами (Hal = F, Cl, Br, I). В обычных условиях ЭF4 - газы, ЭCl4 - жидкости, а ЭBr4 и...
-
Германиевая кислота, Водородные соединения германия - Свойства германия
H4GeO4 (H2GeO3-H2O) - метагерманиевая кислота. В свободном виде (как и мономерные кислородные кислоты углерода и кремния) не получена. При подкислении...
-
Аммиакаты на примере хлорида гексаамминкобальта (III) 1) Разлагаются при нагревании: 2) Разлагаются с горячей водой: 3) Реагируют с разбавленными...
-
При изучении реакций замещения в бензольном кольце было обнаружено, что если в нем уже содержится какой-либо заместитель, то в зависимости от его...
-
Оборудования, используемые для определения ртути Класс опасности - 1, ПДК в населенных пунктах (среднесуточная) -- 0,0003 мг/мі ПДК в жилых помещениях...
-
Соединения азота - Азот, его соединение и свойства. Азот в природе
Из почвы соединения азота попадают в растения. Далее: "лошади кушают овес", а хищники -- травоядных живот-ных. По пищевой цепи идет круговорот вещества,...
-
Оксид фосфора (V), Химические свойства - Фосфор и его соединения
Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V) P4O10 (Рис.4). Часто его формулу пишут в упрощенном виде - P2O5. В...
-
Аллотропные изменения - Фосфор и его соединения
В свободном состоянии фосфор образует несколько аллотропных видоизменений. Это объясняется тем, что атомы фосфора способны, взаимно соединяясь,...
Галогениды урана, Фториды урана - Уран и его соединения