Диоксид титана - Декоративно-защитные пигменты
Диоксид титана (двуокись титана) TiO2 полиморфен, он кристаллизуется в двухсингониях: брукит -- в ромбической, рутил и анатаз -- в тетрагональной, но последние различаются строением кристаллической решетки. В обоих случаях каждый атом титана находится в центре октаэдра и окружен 6 атомами кислорода. Пространственное же расположение октаэдров разное: в анатазе на каждый октаэдер приходится 4 общих ребра, в рутиле только два (рис. 1).
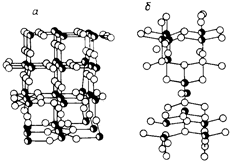
Рис. 1 Атомные модели диоксида титана рутильной (а) и анатазной (б) формы: атомы титана, атомы кислорода.
Элементарная ячейка анатаза состоит из четырех молекул, а рутила только из двух:
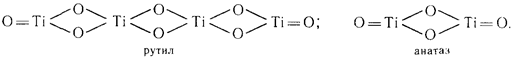
Благодаря более плотной упаковке ионов в кристаллах рутил превосходит анатаз по стабильности, плотности, твердости, показателю преломления, диэлектрической постоянной и обладает пониженной фотохимической активностью. При температуре 915°С анатаз переходит в рутил. Полностью этот процесс заканчивается при 950 °С, но полученный при этом рутил отличается высокой абразивностью и низкой дисперсностью. Поэтому раньше в качестве пигмента применялся только анатаз. В 1949 г. была найдена возможность управления кристаллизацией введением рутилизирующих добавок, а в последующем зародышей, что позволило снизить температуру перехода анатаза в рутил до 850 °С и получать первичные частицы размером 0,15 0,20 мкм округлой формы. Ионы Zn2+, Mg2+, Al3+, Sn2+ являются стабилизаторами рутильной формы, ионы SO42, РО43 -- анатазной. В присутствии даже малых количеств соединений фосфора переход анатаза в рутил становится невозможным. Рутилизирующие зародыши получают, обрабатывая гидратированный диоксид титана после пятой стадии промывки раствором едкого натра. При этом образуется тетратитанат натрия Na2Ti4O3, который обрабатывают соляной кислотой, и пептизируют продукт гидролиза, предварительно освобожденный от ионов SO42. Такие зародыши вводятся перед прокаливанием.
Рутил, прокаленный при температуре около 1000 °С и содержащий примеси Fe, Cr, Ni, Mn, проявляет свойство фототропии. При освещении он становится коричневым, в темноте вновь светлеет. Это объясняется окислением примесных металлов в высшие оксиды вследствие выделения кислорода при освещении ТiO2 с деформированной решеткой.
Минимальное количество примесей, внедрение которых в кристаллическую решетку рутила вызывает изменение окраски, составляет (в г на 1 г ТiO2): 3105 Fe2O3 -- желтая окраска; 1,5106 Сr2O3 -- коричневая: 3105 МnO2 -- серая: 7105 V2O5 -- серо-голубая. Диоксид титана, особенно его гидраты, легко адсорбирует оксиды и гидроксиды железа, которые придают желтую окраску анатазу уже при содержании 0,009 %, рутилу 0.003 %.
В чистом виде диоксид титана, особенно в анатазной форме, обладает высокой фотохимической активностью, что вызывает разрушение лакокрасочной пленки ("меление") и выцветание органических пигментов. Закрытие активных центров поверхности частиц диоксида титана гидроксидами Al, Si, Zn резко уменьшает фотохимическую активность. Такой модифицированный рутильный диоксид титана обладает незначительной фотохимической активностью и пригоден для атмосферостойких ответственных эмалей для автомашин и сельскохозяйственной техники.
Диоксид титана химически инертнен, нерастворим в слабых кислотам и щелочах и органических растворителях. Не ядовит, ПДК в воздухе рабочих зон 10 мг/м3 Диоксид титана может применяться со всеми видами пленкообразователей и растворителей. Пригоден для водоэмульсионных, воднодисперсионных и порошковых красок. Пигментный диоксид титана широко используется для окрашивания в массе изделий из резины, пластмасс, линолеума, бумаги и химических волокон. Лакокрасочная промышленность потребляет 63 65 % всего вырабатываемого пигментного диоксида титана, промышленность пластмасс 12 %, бумажная промышленность 14 %. Помимо пигментного диоксида титана, содержащего 82 95 % (масс.) TiO2, вырабатывается диоксид титана для твердых сплавов, стекол, керамики с более высоким содержанием TiО2. Мировое производство пигментного диоксида титана в 1980 г. составило 2,1 млн. т, из них более 75 % рутильной формы.
Сырье, для получения диоксида титана. Для переработки в пигментный диоксид титана используются минералы: природный рутил, содержащий 92 95 % (масс.) TiO2 и примесь Fe2О3, придающую ему красный цвет (рутил красный); ильменит FeOTiO2 или измененный ильменит-- арканзит Fe2О33TiO2; титаномагнетиты, состоящие из зерен ильменита и магнетита и содержащие 8 12 % (масс.) TiO2.
В чистом виде титансодержащие минералы встречаются редко. Для освобождения от примесей других минералов и пустой породы измельченные руды подвергают магнитному и другим видам обогащения и получают концентраты. Ниже приведен типовой химический состав титаномагнетитовых концентратов, % (масс.):
|
TiO2 |
40 52 |
|
FeO |
26 36 |
|
Fe2O3 |
10 22 |
|
SiO2 |
1 3 |
|
Al2O3 |
0,5 3 |
|
CaO |
0,6 2 |
|
MgO |
0,6 3 |
|
MnO2 |
0,3 0,8 |
|
V2O5 |
0 0,3 |
|
Cr2O3 |
0,006 0,1 |
Наиболее ценным и перспективным сырьем являются титановые шлаки, получаемые при доменной и особенно электрометаллургической переработке титансодержащих руд и концентратов. Содержание ТiO2 в злаках достигает 80 85 % в легко растворимой в серной кислоте форме.
Похожие статьи
-
Белые пигменты и наполнители - Декоративно-защитные пигменты
По масштабам производства и применения в лакокрасочных материалах белые пигменты занимают первое место, они составляют 65 70 % не только для изготовления...
-
Фізичні і механічні властивості титану - Титан та його властивості
Титан дуже тугоплавкий метал. Довгий час вважався, що він плавиться при 1800° С, однак у середині 50-х рр. англійські вчені Діардорф і Хейс установили...
-
Хімічні сполуки титану - Титан та його властивості
З одновалентними галогенами (фтором, бромом, хлором і йодом) він може утворювати ди - три - і, тетраз'єднання, із сіркою й елементами її групи (селеном,...
-
Отримання титану - Титан та його властивості
Ціна - от що ще гальмує виробництво і споживання, титану. Власне, висока вартість - не уроджений порок титану. У земній корі його багато - 0,63%....
-
Властивості титану - Титан та його властивості
У періодичній системі елементів Менделєєва титан має порядковий номер 22. Атомна маса природного титану, обчислена за результатами досліджень його...
-
Химические свойства - Титан и его физические свойства
Устойчив к коррозии благодаря оксидной пленке, но при измельчении в порошок горит на воздухе. Титан устойчив к разбавленным растворам многих кислот и...
-
Температурні, електричні і магнітні властивості титану - Титан та його властивості
Титан має порівняно низьку теплопровідність, всього 22,07 Ут/(мк), що приблизно в 3 рази нижче теплопровідності заліза, у 7 разу-магнію, у 17-20...
-
Декоративные средства для глаз - Химия в косметике
Тушь для ресниц. Для окраски, утолщения и удлинения ресниц и придания им четкой формы косметической промышленностью вырабатывается специальная тушь. Она...
-
Декоративная косметическая пудра - Химия в косметике
Пудра относится к числу изделий декоративной косметики пользующейся большим спросом у потребителя. Ее вырабатывают в порошкообразной, жидкой и...
-
Болезни крови - Желчные пигменты
Кровь, по самой сущности своего образования и по значению своих функций, неизбежно видоизменяется в физическом и химическом отношениях в связи с самыми...
-
З історії відкриття титану - Титан та його властивості
Навряд чи можна знайти ще один такий метал, історія відкриття і вивчення якого були б так повны драматичних подій, помилок і оман, як історія титану....
-
Кровь уже издавна известна людям в качестве более или менее ярко-алой жидкости, наполняющей тело теплокровных и холоднокровных животных. Только в XVII...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Алюминий - самый распространенный в земной коре металл. На его долю приходится 5,5-6,6 мол. доли % или 8 масс. %. Главная масса его сосредоточена в...
-
ХИМИЧЕСКИЕ СВОЙСТВА БОРА. ПРИМЕНЕНИЕ - Химические элементы главной подгруппы III группы
Твердый, хрупкий, блестяще-черный полуметалл. Химически бор при обычных условиях довольно инертен взаимодействует активно лишь с фтором, причем...
-
Металлические стекла - Металлы и сплавы в химии и технике
В самом начале этого реферата мы выяснили, что при обычных условиях затвердевания жидкого металла его атомы образуют кристаллическую решетку того или...
-
Высокая каталитическая эффективность. Отличительной особенностью любого фермента является его чрезвычайно высокая каталитическая эффективность. Так,...
-
Строение, физические свойства, значение воды - Свойства водорода
Вода -- самое распространенное соединение водорода. Общая масса воды на нашей планете около 1,4*1018 т. Вода -- это единственное вещество, все три...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Углерод (лат. Carboneum), С - химический элемент IV группы периодической системы Менделеева. Известны два стабильных изотопа 12С (98,892 %) и 13С (1,108...
-
Висмут - среди металлов, Висмут - химическая индивидуальность - Висмут
В отличие от сурьмы в висмуте металлические свойст-ва явно преобладают над неметаллическими. Висмут одно-временно хрупок и довольно мягок, тяжел...
-
Применение - Важнейшие представители полимеров
В строительной технике полистирол в основном применяют для производства пенополистирола методом поризадии полистирола, в результате чего он получает...
-
Жиры как продукты питания - Общая характеристика жиров
Животные жиры и растительные масла, наряду с белками и углеводами - одна из главных составляющих нормального питания человека. Они являются основным...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Теплотой нейтрализации называется количество теплоты, выделенное при взаимодействии 1 моля эквивалента какой-либо кислоты с 1 молем эквивалента...
-
Для получения монокристаллов арсенида индия с высокими и стабильными электрофизическими параметрами необходимо использовать высокочистые исходные...
-
Методы, применяющиеся для синтеза мультиферроиков - Мультиферроики
Для синтеза мультиферроиков используются различные методы синтеза. К ним относятся: спекание, гидротермальный синтез, соосаждение, золь-гель метод,...
-
НЕМНОГО О ПРОМЫШЛЕННОМ КАТАЛИЗЕ - Процесс катализа
На всю жизнь запомнилась мне проводившаяся по Энглеру разгонка полученного конденсата, в котором уже в начале опыта бензиновая фракция составляла 67%. Мы...
-
Физические и химические свойства - Сера и ее роль в жизни
Атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S-S составляет...
-
Применение благородных газов - Благородные газы и их свойства
Благородные (или инертные) газы, а также их соединения нашли широкое применение в науке и технике. Гелий является важным источником низких температур....
-
Общая характеристика благородных газов - Благородные газы и их свойства
Главную подгруппу восьмой группы периодической системы составляют благородные газы -- гелий, неон, аргон, криптон, ксенон и радон. Эти элементы...
-
Синтетический каучук - Синтетический каучук
Синтетический каучук в промышленном масштабе впервые получен в 1931 году в СССР по способу С. В.Лебедева. На полузаводской установке было получено 260 кг...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
ПОЛУЧЕНИЕ ОБЖИГОВОГО ГАЗА ИЗ КОЛЧЕДАНА. - Получение серной кислоты
Суммарную реакцию обжига колчедана можно представить в виде реакции (I), где ?Н=-853,8 кДж?моль FeS2, или 7117 кДж ?кг. Фактически она...
-
Керамика -- изделия из неорганических материалов (например, глины) и их смесей с минеральными добавками, изготавливаемые под воздействием высокой...
-
Полиэлементоорганосилоксаны - Кремнийорганические полимеры
Введение атомов металлов в полимерную силоксановую цепь существенно меняет физические и химические свойства полимеров. Полиалюмофенилсилоксан и...
-
Одним із перспективних напрямів при дослідженні кристалів ZnS:Mn є дослідження температурних характеристик його спектрів. Нова інформація в цьому напрямі...
-
ЙОД ЙОД - І хімічний елемент VII групи періодичної системи Менделєєва, належить до галогенів (у літературі зустрічається також символ J); атомний номер...
-
Нахождение в природе и получение - Алюминий и его свойства
По распространенности в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия...
-
Полиакрилонитрил (ПАН) [-CH2-CH(CN)-]n синтезируют из акрилонитрила C3H3N аналогично получению полистирола и поливинилхлорида. Он состоит из линейных...
Диоксид титана - Декоративно-защитные пигменты