ОБЗОР ЛИТЕРАТУРЫ - Гидрохимические исследования соленых озер Бурятии на примере озер: Нухэ-Нур, Алгинское и Белое (Оронгойское)
Озера распространены на поверхности суши повсеместно, наибольшая озерность характерна для увлажненных районов древнего оледенения (север Европы, Канада, север США). Много озер в районах многолетней мерзлоты, в некоторых засушливых районах внутреннего стока (юг Западной Сибири, Северный Казахстан), на поймах и в дельтах рек [1].
Около 95% объема воды всех озер на Земле сосредоточено в 1945 самых крупных озерах земного шара. Самое большое на Земле озеро - это солоноватое Каспийское море, из пресных озер самое большое по площади - Верхнее (Северная Америка). Наибольший объем воды сосредоточен в Каспийском море, пресной воды - в Байкале. Байкал также является наиболее глубоким озером в мире [2].
В пределах Байкальского региона насчитывается 18469 озер с общей площадью зеркала 1292 км2, что составляет 0,53% всей площади бассейна. Преобладают небольшие водоемы с площадью водной поверхности менее 1 км2 и лишь 15 озер имеют площадь зеркала более 5 км2. Озерность в пределах бассейна уменьшается с севера на юг - от 0,8-1,2% до менее 0,1%. [3]
Озера подразделяют по размеру, степени постоянства, географическому положению, происхождению котловины, характеру водообмена, структуре водного баланса, термическому режиму, минерализации вод, условиям питания водных организмов и т. д. [4].
По размеру озера делятся на очень большие - площадью свыше 1000 км2, большие площадью от 101 до 1000 км2, средние - площадью от 10 до 100 км2 и малые - площадью менее 10 км2.
По степени постоянства озера бывают постоянными и временными (эфемерными). К последним относятся водоемы, которые заполняются водой лишь во влажные периоды года, а в остальное время пересыхают, и некоторые термокарстовые озера, теряющие воду в летний период.
По географическому положению озера подразделяют на интразональные, которые находятся в той же географической (ландшафтной) зоне, что и водосбор озера, и полизональные с водосбором, расположенным в нескольких географических зонах. Малые озера на равнинах, как правило, интразональны, крупные озера обычно полизональны, также как и горные озера, водосбор которых находится в нескольких высотных ландшафтных зонах.
По характеру водообмена озера бывают сточными и бессточными. Первые сбрасывают по крайней мере часть поступающего в них речного стока вниз по течению. Бессточными считают озера, которые, получая сток извне, расходуют его лишь на испарение, инфильтрацию или искусственный водозабор, не отдавая ничего в естественный или искусственный водоток [4].
В соответствии с общей классификацией природных вод по минерализации озера могут быть разделены на пресные (или пресноводные) с соленостью менее 1‰ (1 г/дм3), солоноватые с соленостью от 1 до 25‰ (1,0-25,0 г/дм3), соленые (озера с морской соленостью) 25-50‰ (25,0-50,0 г/дм3). Озера последней группы иногда называют соляными, а воду с соленостью более 50‰ (50 г/дм3) - рассолом. Озера с соленостью воды выше, чем в океане (35‰ или 30 г/дм3) называют минеральными [1].
Первые сведения об озерах Забайкалья встречаются в монгольской летописи "Сокровенное сказание монголов", датируемой 1240 г. [5]. Научные описания озер Южного Забайкалья появились во второй половине XVIII в, В 1768-1783 гг. академик С. П. Паллас совершает поездку в Восточное Забайкалье и в своих отчетах упоминает о соленых озерах Цаган нур, Зун Торей и Барун Торей [6].
Описания соленых озер Забайкалья встречаются в официальных отчетах командировок, совершенных Г. Гессе, В. С. Титовым, А. П. Герасимовым, И. Ф. Шредом и другими в начале XIX столетия [7]. В 1861 г. выходит в свет работа Л. Озерского "Очерк геологии, минеральных богатств и горного промысла Забайкалья", где даются сведения о некоторых озерах Южного Забайкалья [8].
В 1937 г. В. А. Обручев доказал континентальный характер соляных отложений озер Селенгинской Даурии [9]. А. Г. Франк-Каменецкий провел в 1922 г. исследование Доронинского озера, дал его описание и высказал гипотезу о биохимическом происхождении соды в нем [10].
Г. Ш. Бутырин в 1925 г. в своей статье "Горько-соленые озера Бурят-Монгольской республики и их промышленное значение" дает оценку промышленному значению соляных озер и упоминает об озере Горбунка (Агинский аймак), где в 1922 г. была проведена выварка поваренной соли.
С 1925 по 1929 г. И. Н. Гладилиным и Н. С. Бобинным были произведены детальные исследования озер Селегинского среднегорья (Боргойских), Соленого (Киран) и Доронинского. Ученые дали характеристики геологического строения озерных котловин, высказали суждения о происхождении солей и определили их запасы [11].
В 1962 г. был опубликован фундаментальный труд по минеральным водам Восточной Сибири, в котором были представлены геолого-географические и физико-химические характеристики минеральных озер республики Бурятии, Иркутской и Читинской областей [12].
На территории Байкальской природной территории встречаются Солоноватые, содово-соленые, соленые озера и рассолы, которые по своим характеристикам относятся к экстремальным системам из-за высокой минерализации (25-360 г/дм3) и щелочности (1,5- 450 г/дм3), рН (9-11) [1].
Мнения исследователей о происхождении этих озер расходятся [13]: одни считают, что содовые озера представляют собой континентальные водоемы, которые не были связаны с морем, а накопление солей в них произошло в результате тектонических движений земной коры, другие - что эти озера являются остатками древнего содового моря.
Содовые озера в основном пересыхающие, в маловодный период многие из них исчезают, а в водный период вновь наполняются, поэтому минерализация воды здесь постоянно меняется. Большие циклы колебания уровня озер составляют 50-60 лет, выявлены малые циклы в 10-15 лет, также наблюдаются внутригодовые изменения уровня воды. Водный режим содовых озер зависит от поступлений подземных и атмосферных вод.
На территории Забайкалья насчитывается несколько групп озер: Селенгинской Даурии, Баргузинской долины, долины реки Ингоды, Онон - Борзинского района и др.
Содовые озера, расположенные на территории Республики Бурятия, делятся на две групп: Селенгинской Даурии, Баргузинской долины. Озера Селенгинской Даурии расположены в долине реки Селенга и ее притоков - Джиды, Чикоя и Уды. Котловины содовых озер сложены преимущественно песками и песчаниками юрско-мелового периода и кристаллическими породами (базальтами, гранитами и т. д.). Водно-солевое питание эти озера получают преимущественно за счет атмосферных осадков и их потоков, которые приносят с собой выщелоченные ими соли из слагающих озерную котловину почв и горных пород, а иногда грунтовыми водами [15].
Соляные озера Селенгинской Даурии отличаются невысокой минерализацией вод, неустойчивым режимом и относятся к карбонатному или сульфатно-натриевому типу. До настоящего времени описано более 20-ти озер, хотя в действительности их намного больше [16].
Баргузинская межгорная впадина окаймлена с северо-запада Баргузинским и с юго-востока Икатским горными хребтами. Приустьевые низины р. Баргузин и ее притоков на обширном пространстве от с. Баргузин до возвышенности Верхний Куйтун представляют собой заболоченные участки с множеством мелких озер. Русло реки Баргузин делит долину на две не равные части: правую - очень узкую и значительно возвышенную над уровнем воды в реке и левую - широкую, сравнительно низкую с уровнем воды в реке и в половодье часто затопляемую. Озера Баргузинской долины подразделяются на следующие группы: Усть-Баргузинскую, Кокуйскую, Алгинскую, Усть-Аргадинскую и Кармадонскую.
Основные типы вод в озерах Забайкалья. В соответствии с классификацией Алекина по преобладающим ионам и их соотношению, воды соленых озер в основном относятся к гидрокарбонатному классу, группе натрия, реже встречаются воды класса хлоридно-гидрокарбонатного, натриево-магниевого типа [14]. Отношение (НСО3-+СО32-)/(Са2++Mg2+) изменяется в разные годы в различных соотношениях от 0,6 до 57,6, что указывает на устойчивую содовую стадию развития озера. Н. А. Шмитдебергом в 1969 г. было рекомендовано дополнительно ввести для озер Забайкалья характеристику подтипа вод на основании соотношения (Na++K+)/(Ca2++Mg2+). Значения больше единицы указывает на содово-галитный или сульфатно-натриевый тип воды. Воды озер Южного Забайкалья относятся в основном к типичному содово-галитному подтипу, т. к. соотношение сульфатов к хлоридам колеблется в пределах от 0,1 до 0,9.
Среди катионов преобладают в течение всего года щелочные металлы, т. е. ионы натрия, калия, магния, кальция. Соотношение (Na++K+)/(Ca2++Mg2+) устойчиво находятся в пределах от 4,6 до 25. Уменьшение выше указанных значений ионов происходило преимущественно в холодное время года, когда начинается формирование молекулы соды Na2CО3-10Н2О и троны Na2CО3-NaHCО3-3H2О в озерах.
В летнее время щелочность среды поддерживается в озерах на высоком уровне за счет утилизации свободной углекислоты фитопланктоном. Озерные воды являются летом умеренно жесткими (7,7-8,2 мг-экв/дм3). Жесткость преимущественно определяется ионами Са2+ и Mg2+. В водах содовых озер Забайкалья преобладают ионы Са2+, исчезновение Mg из озерного раствора может происходить за счет его связывания в органоминеральные коллоиды или в результате обменной реакции с ионами Са2+.
Межгодовая и внутригодовая динамика сульфат-иона в озерах Забайкалья характеризуется довольно большой амплитудой колебания концентраций. Смена типов вод в некоторых озерах начинается при переходе от холодного к теплому периоду.
Ведущими факторами формирования солености и химического состава вод минеральных озер принято считать процессы испарительного концентрирования, в ходе которого происходит направленная трансформация химического состава со сменой карбонатного типа сульфатным и далее хлоридным [24], получившая название "прямой метаморфизации состава". Такая последовательность в смене химического типа объясняется осаждением солей по мере насыщения ими озерных вод, сначала наименее растворимых карбонатов кальция и магния, затем сульфатов кальция, натрия и т. д.
Иначе представляют эволюцию химического состава вод минеральных озер О. А. Склярова с соавторами, которые описывают ее в виде двух альтернативных последовательностей [17]:
- (НСО3-)?(Са, Mg, Na) > (HCО3-)?(Mg, Na) > (HCО3-)?(Na); (НСО3-, SО4)?(Ca, Mg, Na) > (НCО3-, SО4)?(Mg, Na) > (SO4, НСО3-)? ?(Mg, Na) > (SO4, Cl)?(Mg, Na) > (Cl)?(Na).
Как следует из данных последовательностей, гидрокарбонатные воды при испарении преобразуются по карбонатному (содовому) типу, гидрокарбонатно-сульфатные - по хлоридному (галитному) типу, хотя исходные воды различаются присутствием в анионном составе сульфатов. Причины различной геохимической направленности трансформации состава вод авторы не объясняют.
В подземных водах зоны гипергенеза, обеспечивающих основную долю солевого питания озер, анионы в эквивалентном выражении по убыванию располагаются в ряд НСО3- > Cl- > SO4-, в том числе в зоне континентального засоления [18]. Если исходить из этого соотношения, то после выпадения карбонатов преобладающим анионом озерных вод должен быть хлорид, эквивалентные концентрации которого в среднем выше, чем сульфата. Следовательно, до стадии выпадения образуемых этими анионами Солей их накопление должно происходить в одинаковой пропорции, и хлориды, даже при более низких весовых содержаниях, по химическому эквиваленту будут доминировать, т. е. Сl- будет определяющим в наименовании химического типа воды (в наименование включаются ионы с содержанием не менее 20%-экв.)
Очевидно, что формирование собственно сульфатных вод в таком случае возможно при наличии особых условий - существовании дополнительных источников поступления в озера сульфатов. Примером могут служить Алгинские озера Баргузинской впадины, в которые сульфаты привносятся термальным водами, или озера межгорных впадин Западного Забайкалья, в солевом питании которых принимают участие сульфатные воды глубоких горизонтов, выполняющих впадины мезозойских осадочно-терригенных отложений [19].
Динамика содержания органического вещества в воде озер тесно связана с температурой (коэффициент корреляции 0,9), которая влияет на активность фитопланктона. Органическое вещество этих озер имеет преимущественно автохтонное происхождение. В связи с относительной мелководностю содово-соленых озер распределения органического вещества по горизонтам не происходит. В некоторых озерах обнаруживается незначительный максимум органического вещества (до 5 мг/дм3) в поверхностных слоях воды, что, вероятно, обусловлено преимущественной концентрацией сестона у поверхности [13].
Главные ионы в водах и их происхождение. К числу главных ионов, содержащихся в природных водах, относятся ионы: CI-, SO42-, НСО3-, Na+, Mg2+, Са2+ и К+, которые образуют основную часть их минерального состава. Главные ионы определяют химический тип вод, иначе их называют Макрокомпонентами. Микрокомпоненты содержатся в водах в гораздо меньших количествах и не определяют химического типа воды. Ряд компонентов, растворенных в водах, занимает промежуточное положение между макро - и микрокомпонентами. К их числу относятся Н+, NH4+, NО3-, H2SiO3. Представленные компоненты в некоторых типах вод могут приобретать первостепенное значение. Массовая концентрация главных ионов в весьма пресных водах выражается первыми единицами миллиграммов в литре, в рассолах же достигает нескольких сотен промиллей (‰) [25].
Хлоридные ионы обладают высокой миграционной способностью, т. е. способностью к перемещению, определяемой физико-химическими константами данного иона и условиями среды, в которой происходит миграция. Они не образуют труднорастворимых минералов, не адсорбируются коллоидными системами (за исключением красноземных почв влажных тропиков), не накапливаются биогенным путем. Растворимость хлоридных солей натрия, магния и кальция очень высокая. Вследствие указанных причин хлоридные ионы беспрепятственно мигрируют с водами. В слабо - и умеренноминерализованных водах ионы хлора обычно находятся на третьем месте. Доминирующее значение они приобретают, как правило, в высокоминерализованных водах и рассолах. Основными источниками поступления иона хлора в природные воды являются: хлористые минералы (галит NaCl, сильвин КСl и др.) из горных пород, почв (особенно солончаков) и скоплений солей; атмосферные осадки; вулканические выбросы; стоки промышленных предприятий и хозяйственно-бытовые отходы.
Сульфатные ионы также обладают хорошей подвижностью, но уступают в этом отношении хлоридным. Содержание SO42- в природных водах лимитируется присутствием в воде ионов Са2+, которые образуют с SO42- сравнительно мало растворимый CaSO4. При невысоком же содержании Са2+ в минерализованных водах наблюдаются концентрации SO42-, выражаемые десятками граммов на 1 л воды. В отсутствие кислорода (в анаэробной среде) сульфатные ионы становятся неустойчивыми и восстанавливаются до сероводорода. Основная роль в этом процессе принадлежит сульфатредуцирующим бактериям, развивающим свою деятельность при наличии органического вещества.
Основным источником появления в воде сульфатов являются различные осадочные породы, в состав которых входят гипс и ангидрит. Немаловажное значение в обогащении вод ионами SO42- Имеют процессы окисления сульфидов, широко распространенные в земной коре. Низкие значения концентрации ионов SO42- могут быть обусловлены привносом сульфатов дождевыми водами. В пустынных условиях поверхностные и грунтовые воды обогащаются сульфатами при выщелачивании солончаков, содержащих кроме галита гипс (CaSO4-2H2O) и мирабилит (Na2SO4-10Н2O). Также в поверхностные воды попадает какое-то количество сульфатов антропогенного происхождения.
Гидрокарбонатные и карбонатные ионы являются важнейшей составной частью химического состава природных вод. Оба эти иона, будучи производными угольной кислоты, находятся в растворе в динамическом равновесии между самой угольной кислотой и составляющими ее ионами в определенных количественных отношениях:
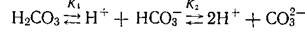
Изменение содержания одного из членов этого равновесия влечет за собой изменение другого. Эти ионы образуют карбонатную систему химического равновесия, имеющую большое значение в природных водах.
Соотношение форм карбонатного равновесия определяет в большинстве случаев в природных водах значение рН. Таким образом, по присутствию той или иной формы угольной кислоты можно судить о рН данной воды.
Гидрокарбонатные ионы встречаются во всех природных водах, кроме, кислых. Они, как правило, доминируют в водах низкой и довольно часто - в водах умеренной минерализации. Накопление в водах ионов НСО3- лимитируется присутствием кальция, образующего с НСО3- слаборастворимую соль.
Ионы CO32- находятся в природных водах сравнительно редко. Из-за очень низкой растворимости карбонатов кальция и магния содержание CO32- редко превышает в водах несколько миллиграммов на литр. Однако в природе известны воды (не часто встречающиеся), в которых содержание CO32- и НСО3- выражается граммами и даже десятками граммов на литр воды. Это так называемые содовые, щелочные воды; в них карбонатные и гидрокарбонатные ионы связаны с ионами натрия, причем кальция и магния в подобных водах мало. Считается общепризнанным, что источником НCO3- и CO32- служат различные карбонатные породы - известняки, доломиты, мергели, и другие, карбонатный цемент многих осадочных пород
Ионы натрия по распространенности среди катионов стоят на первом месте. Все соли натрия обладают высокой растворимостью. Хорошая растворимость Na+ обусловливает его миграцию преимущественно в ионорастворенном виде. Миграционные возможности натрия весьма широки. В этом отношении он уступает только иону хлора, так как может вступать в обменные реакции с поглощенным комплексом пород и, следовательно, выводится из раствора.
Большая часть ионов натрия уравновешивается ионами хлора, образуя подвижное и устойчивое соединение, которое со значительной скоростью мигрирует в растворе. Меньшая, но все же значительная часть Na+ мигрирует в форме сернокислых солей и частично в форме неустойчивых углекислых солей.
Одним из источников появления Na+ в водах являются продукты выветривания изверженных пород (гранит и др.). Другим важным источником Na+ в водах служат залежи его солей, главным образом каменной соли, и рассеянные в почвах и породах его соединения (кристаллики минералов галита, мирабилита и др.).
Ионы калия по химическим свойствам и содержанию в земной коре имеют большое сходство с ионами натрия. Калий так же, как и Na+, образует легкорастворимые соединения с главными анионами (КСl, K2SO4, К2СО3, КНСO3). Однако ионы калия содержатся в природных водах в очень незначительных концентрациях, за исключением атмосферных осадков. Количество калия обычно составляет около 4-10% содержания натрия, с наибольшим процентом в маломинерализованных водах. Но это соотношение под влиянием локальных условий часто нарушается. Причина указанного явления заключается не в химических свойствах данного элемента, а в слабой миграционной способности калия, обусловленной главным образом его большей биологической потребностью для живых организмов, в первую очередь растительных организмов.
Ионы Кальция доминируют в катионном составе слабоминерализованных вод. Гидрокарбонатные кальциевые воды имеют региональное распространение в хорошо дренированных местностях. С ростом минерализации относительное содержание Са2+ быстро уменьшается. Это объясняется сравнительно ограниченной растворимостью сернокислых и низкой растворимостью углекислых солей кальция, вследствие чего при испарительном концентрировании природных вод, имеющем место в аридных условиях, непрерывно выводятся из раствора громадные количества Са2+ в виде CaSO4 - 2Н2О и СаСО3. По этой причине количество Са2+ в природных водах редко превышает 1 г/дм3, обычно его содержание значительно ниже.
Одним из важных источников Са2+ в природных водах являются известняки, доломиты и известковистый цемент горных пород, которые растворяются в воде по следующей схеме:
СаСО3 + СO2 + Н2O - Са(НСO3)2 - Са2+ + 2НСО3-.
Значительные количества кальция переходят в воду за счет растворения гипса, широко распространенного в земной коре. Во всех указанных случаях ионы кальция находятся в водах в сочетании с анионами НСО3- и SO42-
Магний по своим химическим свойствам близок к кальцию. Хотя ионы магния присутствуют почти во всех природных водах, но, тем не менее очень редко встречаются воды, в которых магний доминирует. Обычно же в маломинерализованных водах преобладает кальций, в сильноминерализованных - натрий. Однако лучшая растворимость сульфата и гидрокарбоната магния по сравнению с CaSO4 и Са(НСОз)2 способствует концентрированию Mg2+ в природных водах.
Ионы магния поступают преимущественно при растворении доломитов, мергелей или продуктов выветривания основных (габбро), ультраосновных (дунит, перидотит) и других пород. В водах, формирующихся в перечисленных породах, даже на низких стадиях минерализации ионы магния занимают первое место в катионном составе или разделяют первенство с ионами кальция.
Карбонатная система в природных водах. Карбонатная система представляет собой систему равновесий, самую сложную в природных водах. Общее содержание ее компонентов ?СО2 выражается в виде их суммы:
?СО2=[СО2] + [Н2СО3] + [НСО3-] + [СО32-] моль/дм3.
Помимо угольной кислоты и ее производных, с карбонатной системой связаны ионы водорода и кальция. В целом карбонатная система природных вод является сложным равновесием, включающим в себя ряд равновесий: адсорбционно - гидратационное равновесие раствора с газовой фазой, многоступенчатую диссоциацию в растворе и гетерогенная равновесие раствора с твердой фазой. Общее равновесие можно изобразить схемой:
PCO2 атм.
PCO2 воды Н2СО3 НСО3- + H+ СО32- +Ca2+ + H+
СО32- + Ca2+ CaСО3 раств.
CaСО3 тв.
Изменение в одной из частей общего равновесия вызывает изменение во всей цепи. Например, увеличение в воде СО2 (в результате биохимических или каких-либо других причин) понижает pH, уменьшает концентрацию СО32-, в силу чего вода становится насыщенной CaСО3. При наличии твердой фазы часть избыточной СО2 переводит в раствор новые типы ионов НСО3- И СО32- до установления нового равновесия между НСО3- И СО2 и между СО32- И Ca2+.
Наоборот при уменьшении СО2 (под воздействием фотосинтеза или выделения в атмосферу) повышается pH и СО32- и создается пресыщение CaСО3, которое способствует выделению последнего в осадок.
Расчеты состояния карбонатной системы природных вод имеют большое практическое значение, так как позволяют объяснить многие процессы формирования химического состава природных вод.
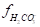
Важнейшим условием устойчивости карбонатной системы в природных водах, помимо равновесия CaСО3 (раствор) CaСО3 (твердый), является равновесие растворенного диоксида углерода (СО2 + Н2СО3) с гидрокарбонатными и карбонатными ионами. Учитывая, что в природных водах с малой минерализацией [H2CO3] CO2 и =1, равновесная концентрация CO2 Может быть определена расчетом на основании совместного решения уравнений:
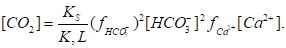
Способность образовывать пересыщенные растворы свойственная большинству солей, но для карбонатной системы границы метастабильного состояния пересыщенных растворов особенно широки. Причины, вызывающие это состояние, разнообразны: образование в начальной стадии твердой фазы карбоната кальция в очень высокодисперсном состоянии, близком к коллоидному, растворимость которой значительно выше, чем макрокристаллов; образование на поверхности высокодисперсных частиц карбоната кальция защитных органических пленок; образование комплексов органических веществ с ионами кальция; образование ионных пар Ca2+,СО32-, НСО3- с другими ионами.
Природная вода может долгое время находиться в пересыщенном состоянии, без выделения в осадок карбоната кальция. Пересыщение карбонатом кальция в 2-3 раза в природных водах - постоянное явление, известны пересыщения и больше 10-кратных.
Для определения степени насыщенности природных вод карбонатом кальция (KS) наибольшее распространение получил метод расчета, рекомендованный О. А. Алекиным. Он основан на том положении, что хотя растворение СаСО3 и содержание в растворе ионов НСО3- и СО32- и зависят от наличия определенной концентрации диоксида углерода, но выделение из раствора CaСО3 определяется концентрацией тех ионов, с которыми Ca2+ образует наименее растворимые соли, т. е. карбонатных ионов. Таким образом, концентрация СО32- является наиболее важной характеристикой процесса выделения CaСО3.[14]
Формирование химического состава озер. Химический состав вод озер Забайкалья сформирован в результате углекислотного выщелачивания силикатных пород с водосборной площади метеорными водами и переноса химических веществ с атмосферными осадками. Климатические условия Забайкалья также влияют на минерализацию и на гидрохимический режим озер. В засушливый период испарительные процессы приводят к концентрации солей, в дождливый происходит разбавление за счет атмосферных осадков; малоснежной и холодной зимой наблюдается вымораживание вод, что приводит к накоплению минеральных веществ в воде и иловых отложениях [10]. По минерализации озера Забайкалья относятся в основном к олигогалитному и мезогалитному типам, содово-галитному подтипу, соотношение сульфатов к хлоридам в этих озерах колеблется в пределах от 0,1 до 0,9. [1]
Основным фактором, влияющим на формирование ионного состава вод озер, является увеличение концентрации ионов натрия, хлора, сульфатов и гидрокарбонатов, в то время как концентрация ионов кальция, магния, калия и карбонатов изменяется мало. Аналогичные закономерности характерны для озер, расположенных на территории России, Австралии, Монголии и других регионов [14].
Изучение химического состава питающих вод позволяет установить направление физико-химических процессов, которые протекают в данных водоемах. Химический состав атмосферных осадков, выпадающих в Забайкалье, имеют гидрокарбонатно-натриевый, кальциевый или магниевый, реже сульфатно-натриевый тип. Минерализация дождевых вод составляет 6-150 мг/дм3. Они более минерализованы, чем снеговые осадки. Количество солей, вносимых атмосферными осадками на зеркало озер, составляет 0,01-0,5%. Свежевыпавший снег имеет минерализацию 10-30 мг/дм3. А переметанный снег имеет высокую минерализацию. Поэтому старый снег по берегам озер и на их ледяном покрове характеризуется высоким содержанием водорастворимых солей (0,4-8,0 мг/дм3).
Грунтовые воды по составу различны, чаще преобладают гидрокарбонатные. В катионном составе могут преобладать и кальций, и магний, и натрий. Средняя минерализация их равна 0,4-0,5 г/дм3, максимальная - 2,5 г/дм3. Напорные воды по составу гидрокарбонатно-кальциевые и натриевые. Большая доля их относится к сульфатному типу, минерализация их составляет т 0,25 до 2 г/дм3. Подземнотрещинно-жильные и трещинно-пластовые воды имеют минерализацию 0,5 г/дм3,редко превышая 1,5 г/дм3, по составу могут быть карбонатными, сульфатно-натриевыми и сульфатно-магниевыми.
Климатические условия Забайкалья определяются его территориальным положением. Забайкальский регион находиться почти в центре обширного Азиатского материка. От морей Забайкалье отдалено не только значительным расстоянием, но и горными хребтами, мешающими проникновению теплого влажного воздуха. Климат Забайкалья суровый и резко-континентальный. Характерны значительные суточные и годовые амплитуды температуры воздуха. Количество осадков, выпадающих в Забайкалье, колеблется для разных пунктов в пределах 250-600 мм в год. Распределяются осадки крайне неравномерно, и заметную роль здесь оказывает рельеф. соленый озеро бурятия осадкообразование
Баргузинская котловина отличается наиболее высокими показателями континентальности климата среди других межгорных котловин Забайкалья. Разнообразие горных, таежных, лесостепных, степных и водных зон формирует здесь особый климат.
Осадки по долине распределяются неравномерно. Наибольшее их количество (до 400-600 мм в год) выпадает на наветренных склонах Икатского хребта, наименьшее (до 300 мм в год) на восточных склонах Баргузинского хребта и в долине [20].
Южная Бурятия отличается повышенным числом солнечных дней в году [21]. Большие положительные величины радиационного баланса в течение лета являются основной причиной прогревания крупных котловин и формирования засушливой погоды в Южной Бурятии.
Общая минерализация воды содово-соленых озер Забайкалья испытывает сезонные и межгодовые колебания. Снижение минерализации озер происходит в весенний период с апреля по май и во второй половине лета. С конца мая до середины июля наблюдается повышение минерализации озерных вод, обусловленное высокой температурой воздуха и незначительным количеством осадков. Такая же сухая и безоблачная погода устанавливается в конце сентября, но температура воды в озерах в это время начинает понижаться, а к концу сентября покрывается льдом. Именно в эти периоды начинается садка мирабилита и других солей [9, 22]. Затем наступает длинный зимний период с начала ноября до конца марта, когда во многих озерах замерзает не только вода, но и донные осадки, и илы, выстилающие дно озерных котловин. При полном замораживании озерной воды происходит подледная садка солей, которая наблюдается и в слабоминерализованных озерах. В основном кристаллизуется мирабилит, гидрогалит, углекислый газ, десятиводная сода, гидрокарбонат и другие соли. С наступлением весны и таянием льдом многие соли, такие как гидрогалит, гидрокарбонат, десятиводная сода и некоторые другие, переходят в раствор, а тогда как мирабилит остается нерастворенным на дне озера. Весной и летом в связи с переходом водорастворимых солей, в том числе карбонатов, бикарбонатов и хлоридов в раствор повышается соленость и общая щелочность, а также значения рН воды. Водородный показатель в некоторых озерах увеличивается до 11, а соленость до 10%. Отсюда можно предположить, что содержание общей щелочности и водородный показатель воды озер в зимнее время снижается, а максимум наблюдается в конце лета, в начале осени.
Похожие статьи
-
Байкальский регион представляет обширную зону распространения соленых озер, образующих целые комплексы связанных между собой водоемов. С давних времен...
-
Первые сведения о стратиграфии юрских отложений изученной площади были опубликованы И. И. Никшичем (1921, 1928). Наиболее значительный вклад в изучение...
-
Изучение фазового состава вмещающих пород сырья и ванадиевой минерализации углерод-кремнеземистой формации Северо-Западного Каратау Нижнекембрийские...
-
Комплексная Цель Модуля : познакомиться С Методами И Результатами Термобарогеохимических Исследований, Которые Можно Использовать При Изучении Генезиса...
-
Минеральные лечебные воды - Минеральные воды Украины
В Украине, благодаря бурному геологическому прошлому, встречается большинство известных природных минеральных вод. Различные по объемам их запасы...
-
Одной из главных проблем при эксплуатации месторождений скважинными штанговыми насосными установками (ШСНУ) являются обрывы штанг и насосно-компрессорных...
-
Мир озер чрезвычайно разнообразен. Встречаются озера - моря и озера - лужи. Глубина озер колеблется буквально от десятков сантиметров до полутора...
-
На Кавказе известно множество баритовых и комплексных баритово-полиметаллических месторождений и рудопроявлений. Основные запасы баритовых руд...
-
Бассейн зоопланктон карельский водоем Карельское побережье Белого моря имеет развитую водную сеть (рис. 1). Наиболее характерны озерно-речные системы,...
-
ВВЕДЕНИЕ - Зоопланктон малых рек - притоков Белого моря и озер их бассейнов
Карелия имеет хорошо развитую гидрографическую сеть. Ее территория относится к бассейнам Белого и Балтийского морей. При этом на беломорскую часть...
-
Гидробиологические исследования на реках Кольского полуострова были начаты В. И. Жадиным в 1936 г. на бассейнах рек Варзуги и Умбы (Жадин, 1940)....
-
Результаты проведенных исследований позволяют сделать следующие выводы: 1. Конкреционный анализ ранне-среднеюрской терригенно-карбонатной толщи...
-
Грановская Н. В. Минералогия и термобарогеохимия Белореченского баритового месторождения (Северо-западный Кавказ). // Зап. Всесоюзн. Минерал. о-ва. 1984,...
-
1. Атлас руководящих форм ископаемых фаун СССР. Т. VIII. Нижний и средний отделы юрской системы /Под ред. Г.Я. Крымгольца. М.: Госгеолиздат, 1947.278 с....
-
Формула Курлова представляет собой псевдо дробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе -...
-
Группа амфиболов - Анализ химического состава амфиболов на примере Хибинского щелочного массива
Конституция амфиболов по сравнению с пироксенами является более сложной, хотя с точки зрения качественного состава между теми и другими много общего....
-
При бурении скважин и вскрытии ими пластов, содержащих высоконапорную воду, последняя начинает поступать в ствол скважины и оказывать влияние на...
-
Геохимический фон и геохимические аномалии Геохимические исследования основаны на изучении распределения и распространения элементов или их соединений в...
-
Объекты исследования Для выбора объекта исследования были изучены картографические материалы, космические снимки с целью нахождения наиболее характерного...
-
Минеральный состав Определение минералогического состава глин методом рентгеноструктурного анализа выполнено на кафедре минералогии и петрографии и в...
-
Основные понятия и определения В озерах нашей планеты содержится в четыре раза больше воды, чем в реках, но их жизнь гораздо менее продолжительна. И если...
-
Параметры, регистрируемые в газометрии - Геофизические исследования скважин
Газовый каротаж основан на изучении содержания и состава углеводородных газов и битумов в промывочной жидкости, а также основных параметров,...
-
Результаты исследований скважин на газоконденсатность Состав и свойства пластовых углеводородных систем залежей Ямбургского месторождения последовательно...
-
Метод избирательных электродов - Геохимические методы исследования скважин
Основой метода избирательных электродов является характерный ионный состав пластовых вод, сопутствующих некоторым полезным ископаемым. Так, пластовые...
-
Гидрогеохимический каротаж (ГГХК) - Геохимические методы исследования скважин
Новый метод исследования скважин, основанный на электрохимических методах анализа состава флюида и позволяющий решать разнообразные задачи...
-
Гидрохимические разрезы и карты с достаточной полнотой должны характеризовать гидрогеологические особенности нефтяного или газового месторождения, давать...
-
Исходное сырье и материалы, методы исследований и анализа В работе использованы химический, рентгенофазовый, микроскопический, термогравиметрический...
-
В отложениях верхней подсвиты джигиатской свиты, конкреционные образования представлены глинистыми сидеритами и известковыми септариями. Нами были...
-
Комплексная Цель Модуля : на Примере Баритового Оруденения Белореченского Полигона Овладеть Приемами Описания Формы Рудных Тел, Рудовмещающих Структур,...
-
Джигиатская свита, является стратиграфическим аналогом псебайской свиты, развита в промежуточной тектонической зоне. Восточной границей ее развития...
-
При разведочном бурении гидрохимические исследования могут решать ряд задач: 1) Разведочное бурение ведется на площади, где промышленная нефтеносность...
-
Первые сезонные наблюдения за состоянием биоценозов и качеством воды в некоторых реках Поморского побережья Белого моря - Шуе (Беломорской), Суме и...
-
Систематические наблюдения за состоянием озоносферы над Антарктикой начались в 50 - х годах ХХ века, после открытия во многих районах Антарктиды...
-
Обзор литературы - Ультразвук в обогащении
Авторами проведены исследования по изучению влияния ультразвуковой обработки черновых золотосодержащих концентратов перед цианированием. Определено, что...
-
Вступление, Минерализация поверхностных вод - Минеральные воды Украины
Минеральными (франц. mineral < лат. minera - руда) водами обычно называются свободно изливающиеся или добытые из земных недр воды, демонстрирующие...
-
Образование битумопроявлений - Куйско-Далдынское месторождение битумов
Реликтовые углеводороды - биологические маркеры условий накопления, преобразования захороненного органического вещества. Ископаемые молекулы,...
-
Подземные воды пласта ЮС11 являются безнапорными гидрокарбонатно-натриевого и хлор-кальциевого типа с минерализацией от 15.5 до 22.6 г/л. В составе вод...
-
Термокислотные обработки - Кислотная обработка в добывающих скважинах
Этот вид воздействия на ПЗС заключается в обработке забоя скважины горячей кислотой, нагрев которой происходит в результате экзотермической реакции...
-
В разрезе месторождения выделяется пять регионально выдержанных водонефтегазоносных комплексов [12]. Все комплексы насыщены однообразными по составу...
-
Основные проблемы развития российской химической промышленности - Мировая химическая промышленность
Существенным тормозом развития Российской химической промышленности является отсутствие крупных эффективных компаний, способных на равных конкурировать с...
ОБЗОР ЛИТЕРАТУРЫ - Гидрохимические исследования соленых озер Бурятии на примере озер: Нухэ-Нур, Алгинское и Белое (Оронгойское)