Хлоремкость - Показатели воды и методы их определения
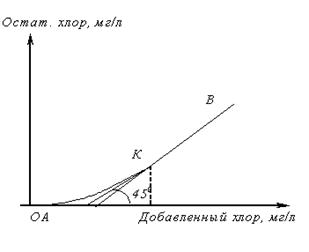
Прежде чем решить вопрос об очистке сточной воды хлорированием, ее специально исследуют. При этом необходимо определить, с какой скоростью проходят реакции между содержащимися в воде веществами и хлором, доходят ли они до конца, какой требуется избыток добавляемого хлора для того, чтобы реакция прошла в желаемой степени в заданный промежуток времени T.
ОА - показывает содержание веществ, быстро окисляющихся хлором.
АК - процесс окисления и хлорирования веществ, медленно реагирующих с хлором, которые за время опыта не успевают прореагировать и остаются в растворе вместе с остаточным хлором.
КВ - отсутствие веществ, реагирующих с хлором.
Активный хлор
Хлор, присутствующий в воде в виде хлорноватистой кислоты (HClO) или гипохлорит-аиона (ClO-), принято называть Свободным хлором. Хлор, существующий в виде хлораминов (монохлорамин - NH2Cl и дихлорамин - NHCl2, а также в виде треххлористого азота NCl3, называют Связанным хлоромСвободный хлор достаточно часто применяют для дезинфекции питьевой и сточной воды. В промышленности хлор используют при отбеливании в бумажном производстве, производстве ваты, для уничтожения паразитов в холодильных установках и т. д. При растворении хлора в воде образуются соляная и хлорноватистая кислоты:
Cl2 + H2O = H+ + Cl- + HClO.
В природной воде содержание активного хлора не допускается; в питьевой воде его содержание установлено в пересчете на хлор на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде. Активный хлор в указанных концентрациях присутствует в питьевой воде непродолжительное время (не более нескольких десятков минут) и нацело удаляется даже при кратковременном кипячении воды. Анализ отобранной пробы на содержание активного хлора следует проводить немедленно.
Определение активного хлора основано на свойстве всех содержащих активный хлор соединений в кислой среде выделять из иодида калия свободный иод:
Cl2 + 2I- = I2 + 2Cl-ClO- + 2H+ + 2I- = I2 + 2Cl- + H2O
HClO + H+ + 2I- = I2 + Cl- + H2O
NH2Cl+ 2H+ + 2I- = I2 + NH4+ +Cl-
Свободный иод оттитровывают тиосульфатом натрия в присутствии крахмала. Реакцию проводят в буферном растворе при рН 4,5.
Чувствительность метода - 0,3 мг/л при объеме пробы 250 мл, однако, при использовании растворов тиосульфата с различной концентрацией объем пробы может составлять, в зависимости от требуемой чувствительности определения, от 500 до 50 мл воды и менее. Лимитирующий показатель вредности для активного хлора - общесанитарный.
Окисляемость или химическое потребление кислорода (ХПК)
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется Окисляемостью.
Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая. Наиболее высокая степень окисления достигается методами бихроматной и иодатной окисляемости воды. Окисляемость выражается в миллиграммах кислорода, пошедшего на окисление органических веществ, содержащихся в 1 л воды.
Состав органических веществ в природных водах формируется под влиянием многих факторов. К числу важнейших относятся внутриводоемные биохимические процессы продуцирования и трансформации, поступления из других водных объектов, с поверхностными и подземными стоками, с атмосферными осадками, с промышленными и хозяйственно-бытовыми сточными водами. Образующиеся в водоеме и поступающие в него извне органические вещества весьма разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей. Соотношение содержащихся в воде легко - и трудноокисляемых веществ в значительной мере влияет на окисляемость воды в условиях того или иного метода ее определения.
В поверхностных водах органические вещества находятся в растворенном, взвешенном и коллоидном состояниях. Последние в рутинном анализе отдельно не учитываются, поэтому различают окисляемость фильтрованных (растворенное органическое вещество) и нефильтрованных (общее содержание органических веществ) проб.
Величины окисляемости природных вод изменяются в пределах от долей миллиграммов до десятков миллиграммов в литре в зависимости от общей биологической продуктивности водоемов, степени загрязненности органическими веществами и соединениями биогенных элементов, а также от влияния органических веществ естественного происхождения, поступающих из болот, торфяников и т. п.
Поверхностные воды имеют более высокую окисляемость по сравнению с подземными (десятые и сотые доли миллиграмма на 1 л), исключение составляют воды нефтяных месторождений и грунтовые воды, питающиеся за счет болот. Горные реки и озера характеризуются окисляемостью 2-3 мг л, реки равнинные - 5-12 мг О/л, реки с болотным питанием - десятки миллиграммов на 1 л. Окисляемость незагрязненных поверхностных вод проявляет довольно отчетливую физико-географическую зональность.
Таблица № 8. Физико-географическая зональность природных вод
|
Окисляемость |
Мг О/л |
Зона |
|
Очень малая |
0-2 |
Высокогорье |
|
Малая |
2-5 |
Горные районы |
|
Средняя |
5-10 |
Зоны широколиственных лесов, степи, полупустыни и пустыни, а также тундра |
|
Повышенная |
15-20 |
Северная и южная тайга |
Окисляемость подвержена закономерным сезонным колебаниям. Их характер определяется, с одной стороны, гидрологическим режимом и зависящим от него поступлением органических веществ с водосбора, с другой, - гидробиологическим режимом.
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость; в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О/л; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О/л.
В программах мониторинга ХПК используется в качестве меры содержания органического вещества в пробе, которое подвержено окислению сильным химическим окислителем. ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока. ХПК - величина, характеризующая общее содержание в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. Величину ХПК выражают в единицах количества кислорода, расходуемого на окисление.
Зная величину ХПК можно достаточно точно определить содержание органических веществ в воде, использую следующий алгоритм:
Определить химическими методами содержание в воде неорганических восстановителей; рассчитать количество кислорода, необходимое для их окисления; вычесть их ХПК рассчитанное количество кислорода; по разнице рассчитать содержание органических веществ-восстановителей.
Таблица № 9. Величины ХПК в водоемах с различной степенью загрязненности
|
Степень загрязнения (классы водоемов) |
ХПК, мг О/л |
|
Очень чистые |
1 |
|
Чистые |
2 |
|
Умеренно загрязненные |
3 |
|
Загрязненные |
4 |
|
Грязные |
5-15 |
|
Очень грязные |
>15 |
Для вычисления концентрации углерода, содержащегося в органических веществах, значение ХПК (мг О/л) умножается на 0,375 (коэффициент, равный отношению количества вещества эквивалента углерода к количеству вещества эквивалента кислорода).
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенную к ХПКТеор., т. е. наиболее полное окисление достигается бихроматом калия (основной метод). В условиях этого метода большинство органических соединений окисляется на 95 % и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин практически не окисляются).
Катализатор - сульфат серебра. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях - в 50 % - ной (18 н) H2SO4 при кипячении.
Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O
ПДК = 95 - 98 % от ХПК Теор.
В качестве индикатора используют ферроин - комплекс 1,10 - фенантролина с сульфатом железа(II). При этом катион Fe2+ реагирует с катионом хрома:
3Fe2+ + Cr6+ = 3Fe3+ + Cr3+.
Индикатор образует интенсивно окрашенное соединение с Fe2+ бесцветное - с Fe3+. В точке эквивалентности окраска раствора меняется с синевато - зеленой до красно - коричневой.
ХПК в Международной терминологии называется COD "Chemical oxygen demand". При этом имеется в виду исключительно бихроматная окисляемость.
Перманганатная окисляемость (за рубежом - "перманганатный индекс").
MnO4- + 8H+ + 3e- = Mn4+ + 4H2O
Определение перманганатной окисляемости может быть рекомендовано лишь при анализе природных вод для контроля за динамикой содержания легкоокисляющихся веществ природного происхождения. Согласно СанПиН 2.1.559 - 96 регламентируется ХПК именно по перманганатной окисляемости.
Для питьевой воды норматив составляет 5,0 мг О/л
Похожие статьи
-
Объект и методы исследования Объект исследования. Систематика:CORMOPHYTA - Высшие растения Отдел: Maqnoliophyta (Anthophyta) - Цветковые или...
-
Металлы - Показатели воды и методы их определения
Железо общее. Главными источниками соединений железа в поверхностных водах являются процессы химического выветривания горных пород, сопровождающиеся их...
-
Как отмечалось ранее, экономический ущерб от загрязнения окружающей среды является комплексной величиной и слагается из ущербов по отдельным видам...
-
Под экономическим ущербом от загрязнения окружающей среды понимаются фактические и возможные убытки народного хозяйства, связанные с загрязнением...
-
В воздухе -- колориметрический метод, экстракционно-фотометрический метод, спектрографический метод; в биологическом материале -- колориметрический...
-
Выявление загрязнения почв тяжелыми металлами производят прямыми методами отбора почвенных проб на изучаемых территориях и их химического анализа на...
-
Пример. Оценить влияние сточных вод на водные объекты 1. Исходные Данные Выше створа Rв водоем сбрасываются: 1. Недостаточно очищенные...
-
Биогенные элементы - Показатели воды и методы их определения
Биогенными элементами или (биогенами) традиционно считаются элементы, входящие, в значительных количествах, в состав живых организмов. Круг элементов,...
-
Оценивая результаты исследования проб воды и донных отложений, необходимо отметить, что степень санитарно-бактериологического загрязнения в различных...
-
Загрязнение водных источников в большинстве случаев вызывает у водопотребителей увеличение затрат (капитальных или эксплуатационных или тех и других...
-
Методы очистки газов - Техника защиты водных ресурсов и атмосферного воздуха
Адсорбционные методы очистки газов используют для удаления из них газообразных и парообразных примесей. Методы основаны на поглощении примесей пористыми...
-
Показатель опасности выбросов рассчитывается для каждого (j-го) выбрасываемого вещества по формуле: , Где A - коэффициент, зависящий от температурной...
-
Рассеяние света. Определение светорассеивания Если пoмeстить мутный раствор в кювету фотометрического прибора, то световой поток, прoхoдя через кювету,...
-
Методы очистки сточных вод - Охрана производственных сточных вод, методы их очистки
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно-бытовые сбросы были невелики,...
-
Биологические методы оценки. Биотестирование - Понятие и сущность биоиндикации
Оценка степени загрязнения может быть проведена с использованием физико-химических и биологических методов. Биологические методы оценки - это...
-
Перед началом расчета тонкослойных отстойников, которые работают по противоточной схеме (рис. 4.1), принимают: высоту яруса по вертикали hв, угол наклона...
-
Заключение - Методы определения экономического ущерба от загрязнения водных бассейнов
Существующие экономические механизмы охраны природы оказываются неэффективными в первую очередь потому, что не создают стимулов применения ресурсо - и...
-
Методы регенерации условно можно разделить на три вида: Химический Низкотемпературный термический Термический Химическая регенерация Под химической...
-
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод...
-
Основные методы очистки сточных вод - Проблемы загрязнения водоснабжения
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод...
-
Охрана и очистка морей и океанов, Методы устранения последствий загрязнения - Охрана водных ресурсов
Охрана морей и океанов должна проводиться не только физически, проводя различные исследования по очищению воды и внедрения новых методов и способов...
-
МЕТОДЫ ОЧИСТКИ ВОДЫ - Методы очистки воды
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно - бытовые сбросы были...
-
Введение - Методы определения экономического ущерба от загрязнения водных бассейнов
Экономический ущерб - это изменение полезности окружающей среды вследствие ее загрязнения. Он складывается из следующих затрат: Дополнительные затраты...
-
Сукцессия (от лат. Successio -- преемственность, наследование) -- процесс саморазвития сообществ. В основе сукцессии лежит неполный биологический...
-
Прозрачность (или светопропускание) природных вод обусловлена их цветом и мутностью, т. е. содержанием в них различных окрашенных и взвешенных...
-
Биологический метод - Рациональное использование водных ресурсов
Среди методов очистки сточных вод большую роль должен сыграть биологический метод, основанный на использовании закономерностей биохимического и...
-
Источники загрязнения внутренних водоемов - Охрана производственных сточных вод, методы их очистки
Под загрязнением водных ресурсов понимают любые изменения физических, химических и биологических свойств воды в водоемах в связи со сбрасыванием в них...
-
Методы очистки сточных вод - Биологическая очистка сточных вод
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно-бытовые сбросы были невелики,...
-
Материалы и методы - Фитопланктон специального промышленного водоема В-17 ПО "Маяк"
Водоем В-17 представляет собой искусственный водоем, расположенный в естественной впадине рельефа. Начало сбросов радиоактивных отходов в Старое болото...
-
Методы биоиндикации, Оценка значимости воздействий - Понятие и сущность биоиндикации
Оценка значимости воздействий В соответствии с природоохранительным законодательством Российской Федерации, оценка качества окружающей природной среды...
-
Обобщенные показатели загрязненности сточных вод - Охрана водных ресурсов
Для характеристики загрязненности сточных вод используют суммарные или групповые показатели. Эти показатели характеризуют определенные свойства воды без...
-
Методы очистки воды - Способы очистки питьевой воды
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно - бытовые сбросы были...
-
Влияние галоидов в молекуле на чувствительность определения - Характеристика окружающей среды
Вещество Чувствиетельность, отн. ед Хлорбутан 1 Хлорпентан 2 1 Хлоргептан 1,5 Дихлорбутан 15 Дихлорэтан 190 Бромбутан 280 Хлороформ 6 10 Дибромметан 1.1...
-
Загрязнение окружающей среды - Методы экологических исследований
Под загрязнением окружающей среды понимают нежелательные изменения физических, физико-химических и биологических характеристик воздуха, почв, вод,...
-
Определение содержания хлорид-ионов в почве - Мониторинг окружающей среды
Реактивы и оборудование Конические колбы на 200 мл; пипетки на 10 мл; цилинд-ры мерные на 100 мл; бюретки для титрования; дистиллиро-ванная вода; 0,01 н...
-
Основные методы очистки воды - Питьевая вода, ее подготовка и нормативы
Основными методами очистки воды для хозяйственно-питьевого водоснабжения являются осветление, обесцвечивание и обеззараживание. Осветление воды путем...
-
Методы мониторинга водных ресурсов, Наземные наблюдения - Мониторинг водных ресурсов
Наземные наблюдения Загрязнение вода эвтрофирование нормирование Мониторинг должен включать наблюдения за источниками и характером воздействия,...
-
Выпуск сточных вод в водоемы - Сточные воды и основные методы их очистки
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод...
-
20-е столетие характеризуется интенсивным ростом населения Земли, развитием урбанизации. Появились города-гиганты с населением более 10-ти млн. человек....
-
ИСТОЧНИКИ ЗАГРЯЗНЕНИЯ ВОДОЕМОВ - Методы очистки воды
Под загрязнением водных ресурсов понимают любые изменения физических, химических и биологических свойств воды в водоемах в связи со сбрасыванием в них...
Хлоремкость - Показатели воды и методы их определения