ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ, Объект исследования, Методы исследования - Влияние свинца и кадмия на активность окислительно-восстановительных ферментов урбанозема и фитоэкстракция тяжелых металлов
Объект исследования
В качестве объекта исследований была использована урбанизированная почва (среднемощная, малогумусная, среднесуглинистая), отобранная на территории теплицы БашГУ г. Уфа. Данный участок теплицы находится неподалеку от заброшенного завода, на котором в течение 30 лет проводилась работа со сплавами тяжелых металлов. Почва также была изменена в результате строительных работ, проводимых на данной территории.
На урбанизированной почве произрастают деревья и травы. В основном преобладает луговая растительность: одуванчик полевой (Taraxacum Officinale), вьюнок полевой (Convolvulus arvensis), тысячелистник обыкновенный (Achillea millefolium), ромашка лекарственная (Matricaria recutita), полынь горькая (Artemisia absinthium), цикорий обыкновенный (Cichorium intybus).
Методы исследования
Для изучения физических и физико-химических свойств почвы определяли:
- - активность окислительно-восстановительных ферментов по методам: каталазы по А. Ш. Галстяну, пероксидазы, полифенолоксидазы по Карягиной, Михайловской, описанным Хазиевым Ф. Х (2005) - полевую влажность, полную влагоемкость и потенциальную кислотность почвы по методам, описанным в книге "Агрохимические методы..., 1975" - pH водной вытяжки по Е. В. Аринушкиной (1970)
Определение полевой влажности почв: (Агрохимические методы..., 1975)
На технических весах определяем массу металлического бюкса с крышкой. Бюкс вдавливаем в почву. Почву подрезаем ножом, бюкс вынимаем и содержимую в ней почву подравниваем вровень с краями бюкса. Определяем массу бюкса с почвой, помещаем в термостат с открытой крышкой на 2 часа при t = 105-110 °С и охлаждаем в эксикаторе. Определяем массу охлажденного бюкса и вновь ставим в термостат на 2 ч., затем охлаждаем и определяем массу. Содержание гигроскопической воды (W) вычисляется по формуле:
W =
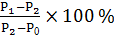
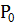
Где: - масса бюкса без почвы;
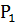
- масса бюкса с почвой до высушивания;
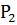
- масса бюкса с почвой после высушивания.
W = =3
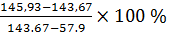
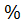
Полная влагоемкость почвы: (Агрохимические методы..., 1975)
Для определения полной влагоемкости необходимо взять стеклянную трубку диаметром 2-3 см, длиной 15 см с одного конца, обвязываем марлевой салфеткой, под которую подкладываем бумажный фильтр, и определяем массу. Трубку заполняем слегка измельченным почвенным материалом до отметки 10-12 см.
Определяем массу трубки с почвой на технических весах. Разность второго и первого определения составляет массу почвы. Трубку медленно погружаем в сосуд с водой, таким образом, чтобы уровень воды был на 1 см выше отметки на трубке, и оставляем ее в таком положении на 15 минут.
Спустя указанное время трубку с почвой извлекаем из воды и в вертикальном положении закрепляем в штативе на 1 мин., чтобы дать возможность стечь избытку воды. В дальнейшем снимаем трубку со штатива, протираем снаружи фильтровальной бумагой для удаления оставшейся воды и определяем массу на технических весах. Расчет воды, удерживаемой почвой после насыщения, производим по формуле:
A =
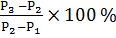
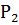
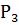
Где -- масса трубки, - масса трубки с почвой, - масса трубки с почвой после ее насыщения водой.
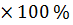
A = = 64
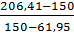
Полную влагоемкость Wmax вычисляем суммированием процентного содержания гигроскопической воды W и воды, удерживаемой почвой после насыщения A:
Wmax = W+A
Wmax = 3 + 64 = 67 %
Отсюда рассчитываем влажность почвы, чтобы она составила 60% от полной влагоемкости при помощи пропорции:
500 г. 100 %
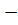
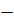
Х 67 %
Х = 335 г.
Находим объем воды для почвы при влажности 60%:
335 г. 100 %
Х 60 %
Х = 201 мл. воды /500 г. Почвы
Кислотность почвы: Кислотность - важнейшая агрохимическая характеристика почвы и выражается обычно величиной рН, или водородный показатель, представляет собой отрицательный логарифм концентрации водородных ионов.
По степени кислотности (величине рН) почвы делятся на следующие группы:
Сильнокислотные рН<4,5
Кислые рН 4,6-5,5
Слабокислые рН 5,6-6,0
Нейтральные рН 6,1-7,0
Щелочные рН 7,1-8,0
Сильнощелочные рН>8,1
Определение величины pH водной вытяжки (Аринушкина, 1970): Почвенную суспензию готовим при отношении почвы к воде 1:2,5. Определение проводим в фильтрате или в суспензии до фильтрования вытяжки. Для этого отбираем в химический стаканчик 10-20 мл суспензии и определяем pH с помощью рН-метра. Это определение выполняем в первую очередь. В зависимости от значения pH определяем щелочность или кислотность водной вытяжки.
Определение pH солевой вытяжки (Агрохимические методы..., 1975): Из каждого хорошо перемешенного образца берем две навески по 20 г воздушно-сухой почвы и помещаем в коническую колбу емкостью 100 мл. В каждую приливаем по 50 мл 50 мл 1 н. раствора хлористого калия.
Содержание колб хорошо взбалтываем и оставляем на ночь до полного оседания почвы и просветления находящейся в колбе жидкости. По окончании указанного срока осторожно, берем пипеткой порцию отстоявшегося прозрачного раствора и определяем в нем рН.
Для приготовления 1,0 н. раствора хлористого калия отвешиваем на технических весах 75 г соли. Растворяем его в 400-500 мл дистиллированной воды и доливаем дистиллированную воду до 1 л.
Реакция раствора должна быть около рН 5,5-6,0 и устанавливаем, в случае необходимости, прибавлением нескольких капель разбавленной соляной кислоты или разбавленной щелочи (если рН раствора меньше 5,5).
Методы определения окислительно-восстановительных ферментов: Для определения активности окислительно-восстановительных ферментов используем методы, описанные Ф. X. Хазиевым (2005):
- - определение активности каталазы по А. Ш. Галстяну (1965); - определение активности пероксидазы по Л. А. Карягиной, Н. А. Михайловской (1986); - определение активности полифенолоксидазы по JI. А. Карягиной, Н. А. Михайловской (1986).
Каталаза (1.11.1.6) (Номенклатура ферментов, 1979) (по методу А. Ш. Галстяна, 1965).
Роль каталазы в живом организме и в почве заключается в том, что она разрушает ядовитую для организмов перекись водорода. Перекись водорода образуется в процессе дыхания живых организмов и в результате различных биохимических реакций окисления органических веществ (Хазивев, 2004; Федотов и др., 2005).
Ход анализа: 1 г навески почвы вносим в 100 мл колбу А (каталазник) добавляем 0,5 г СаСОз, на дно колбы помещаем фарфоровый тигель емкостью 5 мл 3% раствора перекиси водорода.
Плотно закрываем колбу каучуковой пробкой, в которой стеклянная трубка соединяется с мерной бюреткой (Б) толстым резиновым шлангом через тройник (В) (рис. 2). Резиновый шланг через тройник уравниваем грушевидной воронкой, которая соединяется с двумя бюретками. Заполняем водой грушу и бюретки.
С помощью груши, поднимая или опуская, уравниваем уровень воды в груше и бюретках, которая после уравнивания закрепляем на определенной высоте. Затем закрываем тройник для устранения сообщения прибора с внешней средой. Постоянно контролируем необходимый уровень воды в бюретках, что свидетельствует о температурном равновесии в приборе.
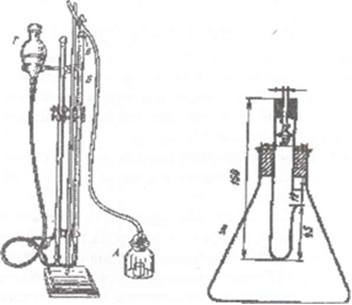
Рис. 2 Газометрическая схема определения каталазной активности.
Начало опыта отмечаем по секундомеру в тот момент, когда сосуд с перекисью опрокидываем и содержимое колбы встряхиваем. Взбалтывание смеси проводим в течение всего опыта, не касаясь колбы руками, держа ее за пробку. Выделяющийся кислород вытесняется из бюретки водой, уровень которой отмечаем через 0,5, 1 и 2 мин.
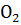
Контролем служит стерилизованная сухим жаром (180°) почва Активность каталазы выражаем в миллилитрах, выделяющегося за 1 мин на 1 г почвы.
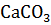
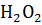
Реактивы: ; 3%-ный раствор. Концентрацию пергидроля проверяем периодически, рабочий раствор готовим непосредственно перед анализом.
Пероксидаза (1.11.1.7) (Номенклатура ферментов, 1979) по методу JI. А. Карягиной, Н. А. Михайловской, 1986).
Пероксидазы осуществляют окисление органических веществ почв (фенолов, аминов, некоторых гетероциклических соединений) за счет кислорода перекиси водорода и других органических перекисей, образующихся в почве в результате жизнедеятельности микроорганизмов и действия некоторых оксидаз.
В качестве субстрата используют гидрохинон, который окисляется под Действием пероксидазы в присутствии кислорода перекиси в 1,4-п-бензохинон, имеющий желтую окраску.
Ход анализа:
1 г почвы в коннческой колбе емкостью 50 мл заливаем 10 мл свежеприготовленного 1%-ного раствора гидрохинона, 1 мл 0,05%-ного на 30 мин при 30 °С. В качестве контроля в термостат помещаем смесь растворов гидрохинона и перекиси водорода без почвы. После инкубации в опытные и контрольные колбы добавляем по 10 мл этилового спирта, тщательно перемешиваем и смесь фильтруем или центрифугируем. Спиртовую вытяжку, имеющую желтую окраску, колориметрируем на фотоколориметре с синим светофильтром против контрольных растворов. Количество парабензохинона рассчитываем по стандартной кривой, составленной с использованием раствора чистого парабензохинона.
Активность пероксидазы выражают в миллиграммах 1,4-п-бензохинона на 1 г почвы за 30 мин при 30°С.
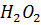
Реактивы: 1) свежеприготовленный 1%-ный раствор гидрохинона; 2) 0,05%-ный раствор ; 3) этиловый спирт; 4) стандартный раствор 1,4-п-бензохинона, рабочие растворы готовят соответствующими разбавлениями.
Полифенолоксидаза (1.14.18.1) (Номенклатура ферментов, 1979) (по методу JI. А. Карягиной, Н. А. Михайловской, 1986).
Полифенолксидазы участвуют в превращении органических соединений ароматического ряда в компоненты гумуса. Они катализируют окисление фенолов до хинонов в присутствии кислорода воздуха.
В качестве субстрата используют гидрохинон. Под действием полифенолксидаз почвы при участии кислорода воздуха гидрохинон окисляется в 1,4-п-бензохинон желтого цвета, который определяется колориметрически.
Ход анализа. Определение активности полифенолксидазы проводим таким же способом, что и пероксидазы; за исключением того, что в реакционную среду не вносим перекиси водорода.
Похожие статьи
-
Чувствительным индикатором антропогенного загрязнения почв является ее ферментативная активность (Хазиев, 2005). Ведущую роль в почвенной биодинамике...
-
Для снижения отрицательного последствия распространения ТМ в природной среде используются мероприятия, которые направлены на предотвращение объектов...
-
Важное место за оценкой экологического состояния природной среды и создания методик по охране окружающей среды от загрязнения ТМ отведено огромное место...
-
Техногенное загрязнение почв с каждым годом катастрофически возрастает, особенно в мегаполисах с преобладанием промышленных центров. Это свою очередь,...
-
Растения являются маркерами геохимического состояния среды, ввиду аккумуляции металлов из воздуха и загрязненных почв, способны накапливать разные виды...
-
Объект и методы исследования Объект исследования. Систематика:CORMOPHYTA - Высшие растения Отдел: Maqnoliophyta (Anthophyta) - Цветковые или...
-
Содержание Таллия в земной коре (кларк) составляет 1,0-0,43-10-4 %, в гранитном слое 1,8-10-4 %. Распределение Таллия в земной коре показывает, что его...
-
Альдрин (аглюкон, вератокс) - инсектицид, отличающийся большой устойчивостью, кумулятивностью и токсичностью. Это сильнодействующее ядовитое вещество,...
-
Введение, Оптические методы анализа. Выбор метода - Прибор контроля мутности сточных вод. Нефелометр
Цель работы: Ознакомление с нефелометрическим методом определения мутности воды в сточных водах производства бытовой химии. Основные задачи для...
-
Методы очистки внесением культур - Биологические методы очистки грунтов
Методы внесения культур микроорганизмов применяются в тех случаях, когда необходимая аборигенная микрофлора отсутствует. Они могут применяться при...
-
При количественных оценках уровня нефтяных загрязнений наибольшее распространение получили методы инфракрасной спектрофотометрии, ультрафиолетовой...
-
Для оценки воздействия любого объекта на окружающую среду большое значение имеет сбор первичной информации. Только опираясь на эту информацию, можно...
-
Объект исследования Объектом нашего исследования являются лиственные деревья г. Славянска-на-Кубани. Материалом для проводимой работы были: гербарий...
-
Незамкнутость техногенного круговорота приводит к загрязнению природной среды, в том числе почвы, различными химическими веществами: тяжелыми металлами,...
-
Загрязнение почв тяжелыми металлами - Микробиологическая индикация загрязнения окружающей среды
Тяжелые металлы могут сильно понижать биологическую активность почв. Прежде всего, они понижают ферментативную активность почв, снижают уровень...
-
Ацетиленовый метод - Методы экологических исследований
Инкубация с ацетиленом предполагает в качестве обязательного условия быстрое и равномерное перемешивание газов в исследуемой системе. Последней может...
-
Фитотоксичность почвы - это свойство почвы подавлять рост и развитие высших растений. Необходимость определения этого показателя возникает при...
-
Методы экологических исследований - Методы экологических исследований
Методологической основой экологии является системный подход в исследованиях. На основе системного подхода изучают свойства высокоорганизованных объектов,...
-
Словарь терминов - Свинец и кадмий в системе "почва - растения - удобрения
ATSDR (Agency for Toxic Substances and Disease Registry) - Агентство по токсическим веществам и регистрации заболеваний. Основано в Атланте, штат...
-
Кадмий (Cd), Кадмий и почвы - Свинец и кадмий в системе "почва - растения - удобрения
Кадмий и почвы В почвы кадмий поступает в составе отходов, образующихся при добыче и переработке цинковых, свинцово-цинковых, медно-цинковых руд; в виде...
-
В настоящее время применяют следующие методы ликвидации нефтяных загрязнений водных объектов: -механические, -физико-химические, -химические,...
-
Бутапон (2,4-Д БЭ, фенагон) - бесцветная жидкость, практически нерастворимая в воде. Технический препарат имеет запах и окрашен в коричневый цвет. Меры...
-
К пестицидам относят химические вещества, применяемые для борьбы с различными вредными организмами: растительноядными клещами (акарициды), насекомыми...
-
Наиболее распространенными среди СПАВ являются анионоактивные вещества. На их долю приходится более 50% всех производимых в мире СПАВ. Анионоактивные...
-
Общие сведения. СПАВ представляют собой обширную группу соединений, различных по своей структуре, относящихся к разным классам. Эти вещества способны...
-
Характеристика объекта исследований Гомельская область - одна из шести областей Беларуси. Расположена в юго-восточной части страны. Гомельская область -...
-
Материалы исследования Данными для дипломной работы послужили лабораторные исследования за химическим составом реки Тошня за 2011 - 2014 года,...
-
Методы расчета нормативов образования отходов - Отходы промышленные и бытовые
В проекте нормативов образования отходов и лимитов на их размещения (ПНООЛР) приводятся обоснования годовых нормативов образования конкретных видов...
-
Последовательность операций при измерении концентрации пыли. Методы измерения концентрации пыли данной группы включают следующие основные операции: 1)...
-
Сравнивая величины рассеянного и падающего света Ir и Io можно определять концентрацию веществ в растворе. Такой метод исследования называется...
-
Методы очистки подземных вод от нитратов и нитритов
Введение Анализ эффективности работы водоочистных станций населенных пунктов Казахстана показал невозможность получения ими нормативного качества...
-
Из литературы и практики известно, что основным направлением повышения энергетической эффективности работы газотранспортной системы Украины и России...
-
Утилизация отработанных буровых растворов - Методы утилизации отработанных буровых растворов и шлама
В данной главе будут приведены примеры технологий утилизации отработанных буровых растворов, применяемые отечественными и зарубежными компаниями. В...
-
Методика определения взвешенных частиц Общие положения. Загрязнение осадков происходит как во время образования в облаке и выпадения их на земную...
-
Заключение - Влияние химических загрязнителей на биосферу
На стыке столетий заметно возросла деловая активность ученых-экологов, сотрудников департаментов и управлений по охране и рациональному...
-
Материалы и методы - Фитопланктон специального промышленного водоема В-17 ПО "Маяк"
Водоем В-17 представляет собой искусственный водоем, расположенный в естественной впадине рельефа. Начало сбросов радиоактивных отходов в Старое болото...
-
Приземный слой атмосферы довольно сильно загрязнен катионами тяжелых металлов. Источником такого загрязнения являются как различные предприятия, так и...
-
Общие сведения. Тяжелый металл голубовато-серого цвета, очень пластичный, мягкий. Т. плавл. 327,4 °C; т. кип. 1725 °C; плотность 11,34 г/см? (20°C)....
-
Кадмий (Kd) Общие сведения. Серебристо-белый металл. Т. плавл. 321,03°; т. кип. 767°; плотн. 8,642 г/см ?. Наряду с ртутью и свинцом кадмий относится...
-
Общая характеристика исследуемого объекта Смоленское управление аварийно-восстановительных работ (Смоленское УАВР) ООО "Газпром трансгаз Краснодар"...
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ, Объект исследования, Методы исследования - Влияние свинца и кадмия на активность окислительно-восстановительных ферментов урбанозема и фитоэкстракция тяжелых металлов