Влияние тяжелых металлов на окислительно-восстановительные ферменты - Влияние свинца и кадмия на активность окислительно-восстановительных ферментов урбанозема и фитоэкстракция тяжелых металлов
Чувствительным индикатором антропогенного загрязнения почв является ее ферментативная активность (Хазиев, 2005).
Ведущую роль в почвенной биодинамике занимают оксидоредуктазы и гидролазы. Ферменты, принадлежащие к группе оксидоредуктаз, ускоряют окислительно-восстановительные реакции, которые играют значительную роль в биохимических процессах почвы и в клетках живых организмов (Вяль, Шиленков, 2009).
Несмотря на ограниченный набор коферментов, оксидоредуктазы способны ускорять большое количество различных видов окислительно-восстановительных реакций. Это происходит благодаря способности соединяться активных групп с другими неактивными группами ферментов, в результате чего образуется всегда оксидоредуктаза, аналогичная по отношению к тому или иному раствору (Мурзабаев и др., 2014).
Из класса оксидоредуктаз значимую часть занимают окислительно-восстановительные ферменты: каталаза, дегидрогеназа, полифенолоксидаза, пероксидаза (Горбов, Безуглова, 2013).
Окислительно-восстановительные ферменты участвуют в разложении токсических соединений перекиси водорода (каталаза), формировании почвенного плодородия (пероксидаза, полифенолоксидаза). Эти ферменты реагируют на воздействие неблагоприятных факторов среды, в частности, на воздействие ТМ, обладающих сильными окислительно-восстановительными свойствами (Минеев, и др., 2001).
Одним из ведущих механизмов устойчивости растений к ТМ является синтез в клетке малочувствительных к ТМ ферментов с другими структурами, которые позволяют действовать в этих условиях (Косицин, Игошина, 1988).
Это происходит за счет изменений в расположении упорядоченности аминокислот, которые не оказывают влияния на активные центры ферментов, не влияют на их каталитические свойства.
Все это приводит к созданию более устойчивых ферментов к подавляющему действию ТМ (Феник и др., 1995). Главная роль в защите растений от негативного действия ТМ отводятся антиоксидантным ферментам (каталаза, пероксидаза, супероксиддисмутаза), которые в свою очередь, увеличивают активность в этих условиях (Шевякова и др., 2003; Wu et al., 2003).
Известно, что ферменты, иммобилизованные на почвенных частицах более устойчивы к воздействию разрушающих факторов (Хазиев, 2007). Следовательно, это оказывает нейтрализацию пероксидов и свободных радикалов, которые образуются под воздействием ТМ (Devi, Prasad, 2005).
Губительная для живых микроорганизмов и растений перекись водорода образующуюся в процессе биологического окисления разлагается на воду и молекулярный кислород
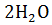
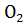
(2>+)
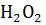
С помощью каталазы (Федотов и др., 2005).
Каталаза - относится к гемопротеидам, в активном центре, которого находится двухвалентное железо. Фермент - каталаза широко распространен в растениях (пероксисомах, митохондриях), в клетках животных и в почвенной биоте (Минеев и др., 2001; Хазиев, 2004; Федотов и др., 2005). Поскольку фермент имеет низкое сродство к перекиси водорода, он начинает функционировать только при относительно высоких ее концентрациях в среде. Замечено, что активность каталазы вниз по профилю мало изменяется, она обратно пропорциональна влажности почв и прямо пропорциональна температуре. Характерная особенность фермента по отношению к субстрату, т. е. к восстановителю незначительна, следовательно, он может катализировать не только расщепление перекиси водорода, а также способствует окислению низкомолекулярных спиртов и нитритов (Гарифзянов и др., 2011, Хазиев, 2005).
Под действием ТМ происходит снижение активности каталазы, ввиду нарушений в строении почвенных микроорганизмов, которые прослеживаются в искажения показателей ферментативной активности почвы (Серегин, Кожевникова, 2008). ТМ способны изменять чувствительность фермента к субстрату, и переводить его в водорастворимое состояние, что, в свою очередь, отражается на скорости реакции. Снижение активности каталазы играет отрицательную роль для почвы, т. к. нарушается расщепление перекиси водорода, которая образуется при биологическом окислении. Однако выявлено, что действие ТМ на ферменты проявляется выборочно, т. е. при одном и том же содержании металлы понижали активность одних ферментов и не изменяли активность других ферментов (Кочетков, Лазарева 1999).
Пероксидаза при помощи перекиси водорода и органических перекисей ускоряет окисление органических химических соединений, которые образуются из ненасыщенных жирных кислот, каротиноидов (Шашурин, 2012). Фермент способствует переносу кислорода от молекулы субстрата к перекиси. Субстратами пероксидазы являются многие соединения - фенолы, нитриты, ароматические кислоты, анилин, толуидин, аскорбиновая кислота и другие соединения (Плешакова и др., 2010).
При этом задача фермента заключается в активировании перекисей, т. к. они проявляют слабое окисляющее действие на фенолы. В дальнейшем цикле может протекать процесс конденсации хинонов с пептидами и аминокислотами, из которых образуется первичная молекула гуминовой кислоты, что в свою очередь способна усложняться за счет повторных конденсаций. Выше перечисленные реакции играют важную роль в процессе образования гумуса (Хазиев, 2005).
Фермент не только принимает участие в циклах почвы, фотосинтеза и дыхания растений, но и играет главную роль в защите растений от инфекционных заболеваний. Отмечено, что уровень повреждения растений, концентрация фенолов и активность пероксидазы находятся в положительной корреляции. Отмечано, что переработка интактного неповрежденного материала находится ниже уровеня окислительных процессов по сравнению с переработкой инфицированного растительного сырья (Белякова и др., 2010).
Действие пероксидазы регулируется с помощью ионов следующих металлов - Mn, Zn, Cu, Ca и др. Их наличие отражается на соотношении собственно оксидазной, оксигеназной и пероксидазной активности. Цианиды и хелаты ведут к уменьшению активности пероксидазы (Хлыстов и др, 2016).
При действии ТМ отмечается повышение активности фермента. Образующаяся перекись водорода при действии ТМ стимулирует активность пероксидазы, что является одним из компонентов реакции (Плешакова и др., 2010).
Полифенолоксидаза - медьсодержащий фермент. Он, как и пероксидаза ускоряет процессы оксисления молекулярного кислорода. Фермент катализирует не только разнообразные реакции полифенолов, но и монофенолов (в частности, тирозина), о-дифенолов с образованием соответствующих хинонов и распадом его в более низкомолекулярные соединения. Полифенолоксидаза занимает ведущее место в образовании гумуса, который является буфером и накопителем токсичных элементов. Уровень активности фермента, служит показателем ускорения процессов минерализации гумуса (Нечаева и др., 2015).
Также, Процесс дыхания растений служит промежуточным звеном в системе "полифенол - хинон" при окислении органических соединений. Наблюдается отличительная особенность активности полифенолоксидазы в онтогенезе растений на окислительный стресс при нанесении вредного воздействия (Физиологические ..., 2000; Давыдова, Тагасов, 2002).
При воздействии ТМ происходит уменьшение активности полифенолоксидазы, ввиду удаления меди из активного центра фермента. Это ведет к нарушению процессов образования органических соединений ароматического ряда в компоненты гумуса. Что, в свою очередь, приводит к снижению плодородия почвы (Хазиев, 2005).
По данным литературы невозможно сделать однозначные выводы относительно влияния разных металлов на активность антиоксидантных ферментов. Активность ферментов, в большей степени, зависит от продолжительности воздействия токсичных ионов. Выявлены также отличия в активности антиоксидантных ферментов в зависимости от органа.
Похожие статьи
-
Техногенное загрязнение почв с каждым годом катастрофически возрастает, особенно в мегаполисах с преобладанием промышленных центров. Это свою очередь,...
-
Растения являются маркерами геохимического состояния среды, ввиду аккумуляции металлов из воздуха и загрязненных почв, способны накапливать разные виды...
-
Важное место за оценкой экологического состояния природной среды и создания методик по охране окружающей среды от загрязнения ТМ отведено огромное место...
-
Загрязнение почв тяжелыми металлами - Микробиологическая индикация загрязнения окружающей среды
Тяжелые металлы могут сильно понижать биологическую активность почв. Прежде всего, они понижают ферментативную активность почв, снижают уровень...
-
Кадмий и растения - Свинец и кадмий в системе "почва - растения - удобрения
Кадмий поступает в растения, в основном, за счет почвы. Значительная доля Cd, попадающего в почву, связывается с почвенными химическими комплексами,...
-
Свинец (Pb), Свинец и почвы - Свинец и кадмий в системе "почва - растения - удобрения
Свинец и почвы Из атмосферы в почву свинец попадает чаще всего в форме оксидов, где постепенно растворяется, переходя в гидроксиды, карбонаты или форму...
-
Незамкнутость техногенного круговорота приводит к загрязнению природной среды, в том числе почвы, различными химическими веществами: тяжелыми металлами,...
-
Словарь терминов - Свинец и кадмий в системе "почва - растения - удобрения
ATSDR (Agency for Toxic Substances and Disease Registry) - Агентство по токсическим веществам и регистрации заболеваний. Основано в Атланте, штат...
-
Наряду с зелеными растениями большую роль в почвообразовательном процессе играют микроорганизмы. Это преимущественно одноклеточные, лишенные хлорофилла...
-
Кадмий (Kd) Общие сведения. Серебристо-белый металл. Т. плавл. 321,03°; т. кип. 767°; плотн. 8,642 г/см ?. Наряду с ртутью и свинцом кадмий относится...
-
Благодаря вышеперечисленным свойствам, почва обеспечивает живущим в ней организмам водоснабжение и минеральное питание. Недостаток воды в почве угнетает...
-
Миграция химических загрязняющих веществ (ХЗВ) в биогеоценозе как наиболее геохимически активном блоке геосистемы тесно связана с их поведением в...
-
Кадмий (Cd), Кадмий и почвы - Свинец и кадмий в системе "почва - растения - удобрения
Кадмий и почвы В почвы кадмий поступает в составе отходов, образующихся при добыче и переработке цинковых, свинцово-цинковых, медно-цинковых руд; в виде...
-
Проблема тяжелых металлов - Основы экологии
К тяжелым металлам (ТМ) относят более 40 химических элементов периодической системы Д. И. Менделеева, масса атомов которых составляет свыше 50 атомных...
-
Шум и его влияние на организм. Предупреждение вредного действия шума на производстве
Шум - беспорядочное сочетание различных по силе и частоте звуков; способен оказывать неблагоприятное воздействие на организм. Источником шума является...
-
Введение - Отрицательное влияние пожара на экологическое состояние окружающей среды
Пожар - довольно частое явление. Причиной возникновения пожара чаще всего становится человеческий фактор. Пожар может возникнуть в бытовых помещениях,...
-
Среди серосодержащих техногенных эмиссий наиболее фитотоксична двуокись серы. Установлено, что SO2 является сильнодействующим ассимиляционным ядом. В...
-
Химические превращения загрязняющих кислотных веществ в атмосфере. - Кислотные дожди
Попадающие в воздух загрязняющие вещества в значительной мере подвергаются физическим и химическим воздействиям в атмосфере. Эти процессы идут...
-
Приземный слой атмосферы довольно сильно загрязнен катионами тяжелых металлов. Источником такого загрязнения являются как различные предприятия, так и...
-
Альдрин (аглюкон, вератокс) - инсектицид, отличающийся большой устойчивостью, кумулятивностью и токсичностью. Это сильнодействующее ядовитое вещество,...
-
Общие сведения. Ртуть - это металл с уникальными свойствами. Он единственный из металлов находится в жидком состоянии при обычных условиях (температура...
-
Вещества, попадающие с выхлопными газами в атмосферный воздух, а затем, оседают на почву. Почвы обладают способностью удерживать и сохранять как...
-
Аккумуляция тяжелых металлов (Mn, Co, Ni) в растениях нижнего течения р. Иле
В последние годы наблюдается увеличение загрязнения окружающей среды, в том числе и тяжелыми металлами. Исследования подтвердили огромный ущерб...
-
Масштабы влияния хозяйственной деятельности человека на природу
Масштабы влияния хозяйственной деятельности человека на природу. С появлением и развитием человечества процесс эволюции заметно видоизменился. На ранних...
-
Микробиологическое состояние и ферментативная активность нефтезагрязненных почв
Основное содержание исследования Казахстан на длительную перспективу предусматривает увеличение добычи "черного золота", а это, в свою очередь, ведет к...
-
С исторической точки зрения интерес проблеме загрязнений почв появился с исследованием плодородия, поскольку такие элементы, как железо, марганец, медь,...
-
Атмосфера обладает мощной способностью к самоочищению от загрязняющих веществ. Движение воздуха приводит к рассеиванию примесей. Пылевые частицы выпадают...
-
Соединения с канцерогенными свойствами, Тяжелые металлы - Проблема экологии Мирового океана
Канцерогенные вещества - это химически однородные соединения, проявляющие трансформирующую активность и способность вызывать канцерогенные, тератогенные...
-
Тяжелые металлы - Антропогенное воздействие на Мировой океан
Тяжелые металлы (ртуть, свинец, кадмий, цинк, медь, мышьяк) относятся к числу распространенных и весьма токсичных загрязняющих веществ. Они широко...
-
Кадмий и человек - Свинец и кадмий в системе "почва - растения - удобрения
Основным источником отравлений Cd является работа в промышленности. Виды деятельности, при которых повышается риск отравления кадмием, таковы: *...
-
Кадмий и удобрения - Свинец и кадмий в системе "почва - растения - удобрения
В зависимости от доз и наличия фосфорных удобрений, кадмий в почве накапливается в разных количествах. Опасным накоплением кадмия считается 3 мг/кг, в...
-
Тяжелые металлы. - Загрязнение окружающей среды и здоровье населения
Тяжелые металлы (ртуть, свинец, кадмий, цинк, медь, мышьяк,) относятся к числу распространенных и весьма токсичных загрязняющих веществ. Они широко...
-
Введение - Источники поступления таллия в объекты окружающей среды
Элемент III группы периодической системы. Атомный номер 81. Природные изотопы: стабильные -- 203Т 929,50 %), 205Т (70,50 %); радиоактивные -- 206Т (Т1/2...
-
Свинец и растения - Свинец и кадмий в системе "почва - растения - удобрения
По современным представлениям, свинец не является физиологически необходимым элементом для растений. Однако есть и другое мнение, согласно которому...
-
Пестициды - химические препараты, используемые для борьбы с вредителями и возбудителями болезней растений, сорняками, вредителями древесины и другого...
-
Природа воздействия Солнечной погоды на биообъекты - Влияние космофизических факторов на биосферу
Анализируя вышесказанное, можно предположить, что воздействие Солнца на биосферу хоть и опосредовано, но имеет электромагнитную природу, поскольку...
-
Цель работы: изучить влияние рН среды и солей тяжелых металлов на изменение цвета флавоноидных пигментов в различных цветковых растениях Собрали...
-
Геохимические циклы (geochemical cycles; н. geochemische Kreisprozesse, geochemischer Kreislauf; ф. cycles gйochimiques; и. ciclos geoquнmiсоs) -...
-
Влияние кислотных дождей на экосистемы и людей - Кислотные дожди и кислотообразующие выбросы
Выпадение кислотных осадков на современном этапе биосферы представляет собой достаточно насущную проблему и оказывает достаточно негативное воздействие...
-
Заключение - Свинец и кадмий в системе "почва - растения - удобрения
Неконтролируемое загрязнение окружающей среды тяжелыми металлами (ТМ) угрожает здоровью людей. В данной работе были представлены сведения о двух тяжелых...
Влияние тяжелых металлов на окислительно-восстановительные ферменты - Влияние свинца и кадмия на активность окислительно-восстановительных ферментов урбанозема и фитоэкстракция тяжелых металлов