Производство кальцинированной соды аммиачным методом, Описание технологического процесса - Очистка сточных вод производства кальцинированной соды
Описание технологического процесса
Сущность процесса состоит в следующем: очищенный от примесей аммонизированный раствор поваренной соли подвергают карбонизации, образующийся бикарбонат натрия выпадает в осадок:
NaCl + NНЗ + СО2 + HO- NаНСО + NH4Cl
Эта реакция обратима, и в равновесных условиях степень использования NaCI не превышает 84%. На практике эта величина составляет 70-75%, вследствие чего до 30% натрия и 100% хлорной части сырья не используется и уходит в отвал с отбросной жидкостью.
Выпавшие кристаллы NaHCO3 отфильтровывают от маточного раствора и подвергают кальцинации с целью получения готового продукта
2 NaHCO3=Na2CO3+ СО2 + H2O
Производство кальцинированной соды по аммиачному способу включает 8 основных стадий:
- - получение карбонатного сырья: вскрыша, взрывные работы, добыча, дробление, сортировка сырья и транспортирование; - переработка карбонатного сырья: обжиг, охлаждение и очистка диоксида углерода, гашение извести с получением известковой суспензии; - очистка рассола: взаимодействие сырого рассола с реагентами в реакторах и отстой рассола; - абсорбция: отмывка в промывателях газов, выделяющихся на других стадиях, от аммиака, двухстадийное насыщение раствора хлорида натрия аммиаком и частично диоксидом углерода, поступающим со стадии дистилляции, охлаждение аммонизированного рассола; - карбонизация: отмывка от аммиака газа, покидающего стадию карбонизации (сопровождается улавливанием диоксида углерода), предварительная карбонизация, карбонизация с выделением гидрокарбоната натрия в осадительных колоннах, компримирование (перед подачей в карбонизационные колонны) диоксид углерода, поступающего со стадий переработки сырья и кальцинации; - фильтрация: отделение гидрокарбоната натрия на фильтрах и отсос воздуха вакуум - насосами; - кальцинация: обезвоживание и разложение гидрокарбоната натрия в содовых печах, охлаждение и очистка диоксида углерода после содовых печей; - регенерация аммиака (дистилляция): предварительный подогрев и диссоциация содержащихся в фильтровой жидкости карбонатов и гидрокарбонатов аммония в конденсаторе и теплообменнике дистилляции, смешение и взаимодействие нагретой жидкости с известковой суспензией в смесителе и отгонка аммиака в дистиллере.
Весь содовый процесс полностью может быть изображен следующими химическими уравнениями:
NH3+H2O= NH4OH
CO2+ H2O=H2CO3
H2CO3+ NH4OH= NH4HCO3+ H2O
NH4HCO3+ NaCl=NaHCO3+ NH4Cl
2 NaHCO3>Na2CO3+ H2O+ CO2
CaCO3 > CaO+ CO2
CaO+ H2O= Ca(OH)2
Ca(OH)2+2 NH4Cl= NH4OH+CaCl2
NH3 H2O
Взаимную связь реакций можно изобразить следующей схемой:
CaCO3=CaO+CO2
NaCl + NH3 + CO2 + H2O- NH4Cl+ NaHCO3
CaO+ H2O> Ca(OH)2 -ДЗ=63,8 кДж/моль
Ca(OH)2 +2 NH4Cl>2 NH3 + CaCl2 + H2O+ДЗ=27,6
NaHCO3>Na2CO3+ CO2+ H2O+ДЗ
Реализация химической модели сопряжена с разработкой технологического режима с использованием физико-химических свойств водной четырехкомпонентной системы.
В водном растворе существуют четыре компонента NaCl - NH4HCO3 - NH4Cl - NaHCO3 (независимых компонентов - четыре, ибо если известны значения трех компонентов, то по уравнению реакции можно рассчитать содержание четвертого.) Соль NH4HCO3 образуется в результате взаимодействия в растворе СО2 и NH3:
СО2 (p) + 2NH3(p)-NH2COONH4(p) - ДЗ1
Образовавшийся карбамат гидролизуется:
NH2COONH4(p)+H2O-NH4HCO3(р) +NH3(p) + ДЗ2 -ДЗ+ДЗ= -63,8 кДж
Температурный режим избран по результатам исследования реакций, а материальные расчеты и соотношения реагирующих компонентов определены по данным о четырехполюсной системе. Ниже приведены графические методы разработки технологического режима для реакций такого типа. На основании диаграммы (рис. 4) устанавливают, что хлорид натрия взаимодействует с бикарбонатом аммония, образуя бикарбонат натрия и хлорид аммония, и растворимость бикарбоната натрия в этой системе мала, так как в равновесном растворе 1 моль бикарбоната растворяется в 4240 молях воды, т. е. практически впадает в твердую фазу. Проекция диаграммы на квадрат солевого состава представлена на рис. 5
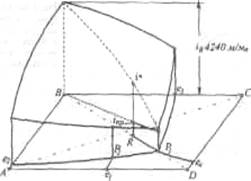
Рис. 4. Система Na+, NH4+¦Cl-,HCO3- - H2O, Т 30єС:
А - NaС1; B - NaHCO3; C - NH4CO3; D - NH4Cl; I - количество H2O - молей воды/1 моль У солей; i* - равновесное, inp - практическое R-отношение А:С, вступающих в реакцию; Р - солевой состав раствора
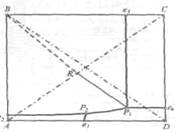
Рис. 5. Проекция системы Na+, NH4+¦Cl-,HCO3- - H2O, Т 30єС:
А - NaС1; B - NaHCO3; C - NH4CO3-; D - NH4Cl; e - солевой состав эвтонических растворов двухкомпонентных систем; Р - нонвариантные точки четырехкомпонентной системы; R - солевой состав реакционной смеси
Стабильной диагональю солевого квадрата, которая пересекает только два полюса кристаллизации, является диагональ бикарбоната натрия - хлорид аммония, соотношение между реагирующими компонентами выбирают графически по проекции диаграммы, учитывая необходимость получения бикарбоната натрия, не содержащего в твердой фазе аммонийных солей. Иллюстрацией этого приема служит рис 6. Он заключается в создании в растворе несколько увеличенного содержания воды по сравнению с нонвариантной фигуративной точкой Р1, на которую направлен луч кристаллизации.
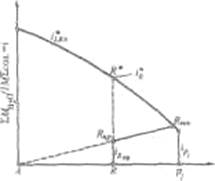
Рис. 6 Сечение диаграммы по ARP1:
I*LBN - количество воды в равновесном растворе; iR. пр - количество воды в технологическом растворе; iP1 - количество воды в растворе Р1; R - фигуративная точка реакционной смеси.
Для возвращения в производство аммиака маточную жидкость, содержащую (в г/л): 180-200 NH4Cl, 70-80 NaCl, 100-непрореагировавшего NHHCO, обрабатывают известковым молоком:
2NH4Cl + Ca(OH)= 2NНЗ + 2СО2 + CaCl2
Образующийся при этом аммиак отгоняют паром и возвращают в цикл.
На станции регенерации аммиака образуется до 10-12 куб. метров отбросной (дистеллерной) жидкости на каждую тонну кальцинированной соды. Состав дистеллерной жидкости изменяется в определенных пределах и зависит от качества рассола и известняка, объема получаемой жидкости, степени утилизации NaCl, концентрации известкового молока и других факторов. Дистеллерная жидкость представляет собой суспензию нерастворимых продуктов (CaCO3, CaSO4, Са(ОН)2 , песка и др. ) в растворе хлоридов кальция и натрия. Средний состав этой жидкости (в г/л): 85-95 CaCl; 45-50 NaCl; 6-15 CaCO3; 3-5 CaSO4; 3-10 Mg(OH)2; 2-4 CaO; 1-3 Fe2O3 + Al2O3 ; 1-4 SiO.
На 1т Na2CO3 в отвал выбрасывают 1 т CaCl2 и 0,5 т NaCl и 200-280 кг твердых нерастворимых примесей. Для захоронения эту жидкость перекачивают в шламонакопители.
Кроме дистеллерной жидкости отходами производства кальцинированной соды являются шламы очистки рассола, состоящие из CaCO3 И Mg(OH)2.
Уменьшение количества образующихся отходов в существующем содовом производстве возможно за счет внедрения следующих мероприятий:
- - внедрения систем оборотного водоснабжения (использование очищенных стоков для выщелачивания NaCl); -замены суспензии известкового молока, используемого для разложения хлорида аммония на сухую известь или известь-пушонку, приготавливаемую путем гашения оксида кальция дистеллерной: жидкостью (приводит к уменьшению объема дистиллерной жидкости на 16-18%). - применение воздушного охлаждения вместо водяного; - увеличение степени использования NaCl; - замены пара, используемого для дистилляции, парам, получаемым при упарке дистиллерной жидкости [6].
Похожие статьи
-
Кальцинация гидрокарбоната натрия - Очистка сточных вод производства кальцинированной соды
Кальцинация - термическое разложение гидрокарбоната натрия - является заключительной стадией в производстве кальцинированной соды. Основным назначением...
-
Технологическая схема отделения фильтрации - Очистка сточных вод производства кальцинированной соды
Суспензия бикарбоната натрия из мерников карбонизационных колонн поступает в коллектор 2, распределяющий ее по отдельным фильтрам. Из коллектора 2...
-
Карбонизация аммонизированного рассола - Очистка сточных вод производства кальцинированной соды
Процесс карбонизации (насыщения аммонизированного рассола диоксидом углерода), в результате которого образуется гидрокарбонат натрия, является основным...
-
Абсорбция - Очистка сточных вод производства кальцинированной соды
Назначение абсорбера состоит в том, чтобы произвести окончательное насыщение рассола из промывателя колонн аммиаком. Рассол поваренной соли, содержащий...
-
Переработка содопоташных растворов - Очистка сточных вод производства кальцинированной соды
Основными компонентами содопоташного раствора является Na2CO3, К2CO3 , K2SO4 и КСl. Раствор, полученный методом двустадийной бикарбонатной карбонизации,...
-
Технологическая схема отделения абсорбции - Очистка сточных вод производства кальцинированной соды
Технологическая схема отделения абсорбции должна обеспечить высокую степень очистки выхлопных газов от аммиака, для чего необходимо промывать эти газы...
-
Под словом "сода" в промышленности, торговле и домашнем хозяйстве подразумевают целый ряд общеизвестных и необходимых химических продуктов, как-то: 1)...
-
Вода - Очистка сточных вод производства кальцинированной соды
На содовых заводах воду расходуют в основном для охлаждения жидкостей и газов. Сравнительно меньше ее расходуют на чисто технологические нужды, например...
-
Водяной пар - Очистка сточных вод производства кальцинированной соды
Для получения пара воду нагревают до температуры кипения, которая зависит от давления получаемого пара. При давлении 760 мм рт. ст. чистая вода кипит при...
-
Метод Гонигмана - Очистка сточных вод производства кальцинированной соды
После Сольвэ наибольший успех в производстве кальцинированной соды путем аммиачного процесса выпал на Морица Гонигмана, который удачно разрешил задачу...
-
Из выше изложенного следует, что реальные сточные воды - это не чистые стабильные растворы, а гетерогенная смесь растворенных, коллоидных и взвешенных в...
-
Схемы очистки сточных вод ЦБП. Технологическая схема - Сточные воды целлюлозно-бумажных производств
При разработке и проектировании систем очистки стоков необходимо учитывать некоторые специфические особенности целлюлозно-бумажного производства: Наличие...
-
Методы регенерации условно можно разделить на три вида: Химический Низкотемпературный термический Термический Химическая регенерация Под химической...
-
Заключение, Литература - Очистка сточных вод производства кальцинированной соды
Одна из особенностей современного промышленного производства - образование значительного количества отходов, поступающих в окружающую среду. Современное...
-
20-е столетие характеризуется интенсивным ростом населения Земли, развитием урбанизации. Появились города-гиганты с населением более 10-ти млн. человек....
-
Выбор оптимальных технологических схем очистки воды - достаточно сложная задача, что обусловлено преимущественным многообразием находящихся в воде...
-
20-е столетие характеризовалось интенсивным ростом населения Земли, развитием урбанизации. Появились города-гиганты с населением более 10-ти млн....
-
Состав сточных вод и основные методы их очистки - Сточные воды и основные методы их очистки
Водоотводящие системы и сооружения - это один из видов инженерного оборудования и благоустройства населенных пунктов, жилых, общественных и...
-
Водоотводящие системы и сооружения - это один из видов инженерного оборудования и благоустройства населенных пунктов, жилых, общественных и...
-
Очистка воды с помощью коагуляции - Методы очистки воды
Коагуляцией называют процесс, при котором мелкодисперсные частицы находящиеся в растворе укрупняются до видимых размеров. В итоге образуются хлопья...
-
ВВЕДЕНИЕ - Адсорбенты и ионные обменники в процессах очистки природных и сточных вод
Объем потребляемой в мире воды достигает 4 трлн. м3 в год, а преобразованию со стороны человека подвергается практически вся гидросфера. Так при...
-
Технологические особенности метрологического обеспечения конвертерного производства В настоящее время прирост объема выплавляемой стали во всех ведущих...
-
Очистка сточных вод методами флотации: - Очистка сточных вод методами флотации
Флотация пузырьками, образующимися путем механического дробления воздуха (механическими турбинами-импеллерами, форсунками, с помощью пористых пластин и...
-
Очистные сооружения бытовых сточных вод 1. Технологическая схема станций предусматривает очистку хозяйственно-бытового стока до требований, предъявляемых...
-
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод...
-
Для проведения пенной флотации производят измельчение руды до крупности 0,5-1,0 мм в случае природногидрофобных неметаллических полезных ископаемых с...
-
Для очистки воды все большее применение находят неуглеродные сорбенты естественного и искусственного происхождения (глинистые породы, цеолиты и некоторые...
-
Основные методы очистки сточных вод - Проблемы загрязнения водоснабжения
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод...
-
Особую опасность представляют соединения азота и фосфора, в больших количествах попадающие в водоемы с бытовыми промышленными сточными водами, из...
-
Тяжелые металлы - Адсорбенты и ионные обменники в процессах очистки природных и сточных вод
К стойким химическим загрязнителям кумулятивного действия со специфическими токсическими свойствами относятся и тяжелые металлы. Тройку наиболее...
-
Пестициды, Нефтепродукты - Адсорбенты и ионные обменники в процессах очистки природных и сточных вод
Ежегодно в окружающую среду вводится 2 млн. т пестицидов (хлорорганические и фосфорорганические соединения, производные карбаматов, хлорфенксикислот) ....
-
Различают природную, сточную и денатурированную воду. Природная вода - это вода, которая качественно и количественно формируется под влиянием...
-
Системы очистки на производстве - Оценка жизненного цикла облицовочной и напольной плитки
Важными участками снабжения и переработки отходов на предприятиях по производству керамических изделий являются установки по удалению пыли и дымовых...
-
Москва первый по величине и по значению город России, и из-за своей величины в ней сосредоточено огромное количество промышленных предприятий. Объем...
-
Дополнительным источником загрязнения рек в черте г. Москвы являются речные снегосвалки. Постановлениями правительства Москвы от 15.11.91 № 809 "О...
-
Вода - ценнейший природный ресурс. Она играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Процесс полной трехстадийной биологической очистки - Биологическая очистка сточных вод
Процесс полной биологической очистки протекает в три стадии. На первой стадии, сразу же после смешения сточных вод с активным илом, на его поверхности...
-
Введение - Охрана производственных сточных вод, методы их очистки
Вода - ценнейший природный ресурс. Она играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Сравнивая величины рассеянного и падающего света Ir и Io можно определять концентрацию веществ в растворе. Такой метод исследования называется...
-
Заключение - Охрана производственных сточных вод, методы их очистки
Защита водных ресурсов от истощения и загрязнения и их рационального использования для нужд народного хозяйства - одна из наиболее важных проблем,...
Производство кальцинированной соды аммиачным методом, Описание технологического процесса - Очистка сточных вод производства кальцинированной соды