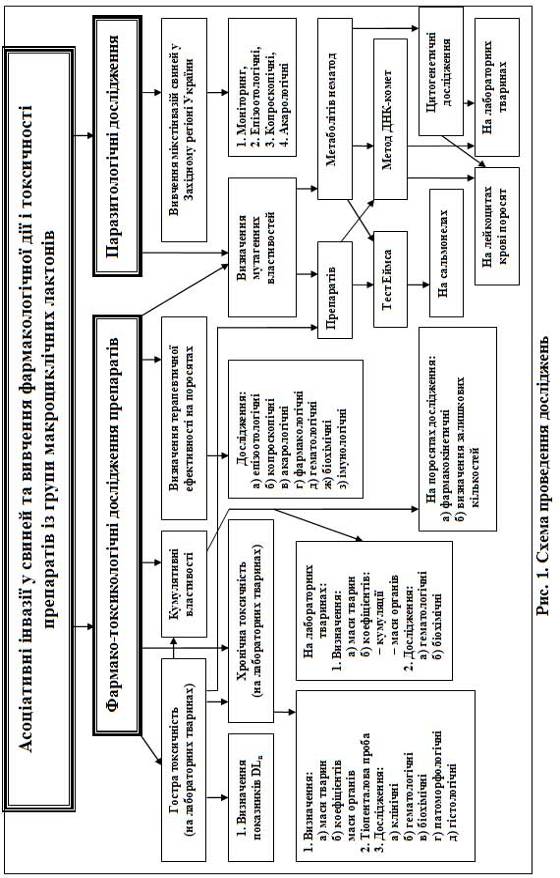
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕНЬ - Асоціативні інвазії у свиней (епізоотологія, розробка, фармако-токсикологічне та терапевтичне обгрунтування щодо застосування бровермектин-грануляту)
Дисертаційна робота виконана протягом 1998-2007 років. Гельмінтологічні та фармакологічні дослідження препаратів виконані на кафедрах паразитології та водних біоресурсів, фармакології та токсикології Львівської національної академії ветеринарної медицини імені С. З. Гжицького. Дослідження епізоотологічної ситуації асоціативних інвазій свиней проводили у господарствах Західного регіону України. Відомості про поголів'я свиней, спеціалізацію і технологію виробництва, паразитологічну ситуацію ми отримували та аналізували із матеріалів звітності обласних державних лабораторій ветеринарної медицини та інформації отриманої безпосередньо від власників і спеціалістів свиногосподарств.
Експериментальні та клінічні дослідження на свинях проведено у господарствах: ТзОВ агрофірма "Угринів" Сокальського району і ПП "Західний Буг" Буського району (Львівська область), СГПП "Рать" Луцького району (Волинська область), ПСП "Шпанівське" Рівненського району (Рівненська область), селянсько-фермерського господарства Ю. М. Веденівського Кіцманського району (Чернівецька область). Для досліджень використовували препарати: бровермектин 1%, бровермектин-порошок і бровермектин-гранулят виготовлені НВФ "Бровафарма" (Україна) і баймек фірми "Bayer AG" (Німеччина).
У базових господарствах, у різні пори року, регулярно відбирали кал для дослідження на наявність яєць і личинок гельмінтів, визначали екстенсивність та інтенсивність гельмінтозної інвазії. Виділені яйця аскарисів і трихурисів, личинки езофагостом культивували до інвазійної стадії. Зараження поросят інвазійними яйцями і личинками проводили індивідуально, перорально за допомогою металевого зонда за методикою Г. А. Котельникова та В. М. Хренова (1984).
У приміщеннях, де утримували тварин, відбирали зішкреби з підлоги, стін, загородок станків, годівниць, змиви з автопоїлок, мітли, скребків, взуття обслуговуючого персоналу та досліджували на наявність яєць гельмінтів за методом А. І. Корчагіна (1986).
Токсикологічні дослідження виконували на клінічно здорових лабораторних тваринах, яких підбирали за принципом аналогів та утримували в однакових умовах згідно з методичними рекомендаціями "Токсикологічний контроль нових засобів захисту тварин" (Косенко М. В. з співавт., 1997) та "Доклінічні дослідження ветеринарних лікарських засобів" (Коцюмбас І. Я., 2006).
Встановлення параметрів гострої токсичності проводили на 90 білих мишах та 78 білих щурах. Середньосмертельні дози (DL50) вираховували за методами Г. Кербера (1931), Г. Першина (1939), Ж. Т. Літчфільда та Ф. Уілкоксона (1949), В. Б. Прозоровського (1962) та Б. М. Штабського (1980).
Хронічну токсичність вивчали на 48 білих щурах, аналогічних за масою. З них було сформовано 4-и групи по 12 щурів у кожній.
Тварини І групи були контрольними, їм вводили 1,5% розчин крохмалю. Щурам трьох дослідних груп вводили бровермектин-гранулят у дозах: ІІ групи - 200 мг/кг (1/60 DL50) - терапевтичну, ІІІ групи - середню між терапевтичною та 1/10 DL50 - 480 мг/кг, тобто 1/25 DL50 та ІV групи - 1/10 DL50 - 1200 мг/кг. Масу тіла визначали зважуванням перед початком досліду на 7 та 30 доби.
Властивості препарату щодо кумуляції визначали на 12 білих щурах, які були поділені на дві аналогічні групи, за методикою Lima K. S. et al., 1961. Коефіцієнт кумуляції визначали за формулою, запропонованою Ю. С. Каганом і В. В. Станкевичем (1964). Сумарно введену середню дозу препарату на одну тварину визначали за К. К. Сидоровим (1961).
Бровермектин-гранулят на 1,5% розчині крохмалю у гострому і хронічному (30 діб) дослідах та в досліді щодо кумуляції (24 доби) вводили лабораторним тваринам натще, внутрішньошлунково за допомогою зондів. Упродовж усіх дослідів проводили спостереження за клінічним станом лабораторних тварин.
У кінці тривалих дослідів тварин зважували, декапітували за легкого ефірного наркозу та одержували від них зразки крові для проведення гематологічних і біохімічних досліджень. Після розтину від тварин відбирали органи, зважували та визначали коефіцієнти їх маси. У щурів кожної групи, за розвитку хронічного досліду, на наступну добу після останнього введення бровермектин-
Грануляту, визначали дезінтоксикаційну функцію печінки. Для цього тваринам внутрішньочеревно вводили 1% розчин тіопенталу натрію в дозі 40 мг/кг маси тіла і визначали тривалість їх сну (Єлизарова О. Н. и др., 1974).
У хронічному досліді, на наступну добу після останнього введення бровермектин-грануляту та на 15 добу (період відновлення), у щурів після забою (при легкому ефірному наркозі) здійснювали макроскопічні та гістологічні дослідження внутрішніх органів за загальноприйнятими методиками (Меркулов Г. А., 1969). Мікрофотографування проводили з використанням мікроскопа "OLIMPUS CX 41" при збільшеннях х 200 та х 400.
Визначення кінетичних параметрів і термінів виведення залишків івермектину проводили на 20 поросятах 3,5-місячного віку, з яких було сформовано чотири аналогічні групи (n = 5). Бровермектин-гранулят згодовували протягом 7 діб у формі лікувально-кормової суміші (з розрахунку 0,2 г/кг маси тіла). Перед початком досліду, на третю добу згодовування, а також на 1; 7; 14 доби після закінчення згодовування, від поросят І групи відбирали проби крові. Від тварин ІІ, ІІІ та ІV груп, відповідно, на 1; 5 та 8 доби після закінчення згодовування та забою відбирали зразки печінки, м'язової та жирової тканин для визначення залишкових кількостей івермектину методом імуноферментного аналізу (ЕLISА) із застосуванням тест-систем виробництва Євро-Діагностика (Нідерланди). Кольорову реакцію у планшетах вимірювали на рідері Тіtегtек Multiscan (Великобританія). Кількісний розрахунок вмісту івермекгину в пробах проводили із застосуванням ПЗ Ridawin (Crooks S. R.H. et al., 1988, Celine M. et al., 2002).
Визначення фармакологічних властивостей і терапевтичної ефективності препаратів групи івермектинів проводили на відібраних за принципом аналогів 78 поросятах великої білої породи 2-4 - місячного віку з спонтанним ураженням саркоптозом. Поросят І, ІІ і ІІІ груп інвазованих саркоптозом, експериментально заражали інвазійними яйцями аскарисів у кількостях 500, 750 і 1000 тис./кг; IV, V і VI груп - трихурисів у кількостях 1000, 1500 і 2000 тис./кг; VII, VIII і IX груп - інвазійними личинками езофагостом у кількостях 1500, 2000 і 2500 тис./кг; X групи - одночасно інвазійними яйцями в кількості 200 А. suum і 350 T. suis та 500 інвазійних личинок Oe. dentatum на 1 кг маси тіла тварини; XI групи - 400 інвазійних яєць А. suum і 700 T. suis та 1000 інвазійних личинок Oe. dentatum, а поросят XII групи відповідно - в кількостях 600, 1050 та 1500 інвазійних яєць і личинок на 1 кг маси тіла тварини. Суміш яєць і личинок у вказаній кількості у 2% крохмальній суспензії вводили перорально за допомогою металевого зонда. Поросята XIII групи (інтактні) були контролем. Їм вводили 2% крохмальний розчин. Після їх зараження проводили підшкірну ін'єкцію бровермектином 1% і баймеком в терапевтичних дозах - 1 мл/33 кг, а бровермектин-гранулят у дозах: 0,1; 0,15 і 0,2 г/кг маси тіла давали із комбікормом 7 діб підряд. Економічну ефективність баймеку, бровермектину 1% та бровермектин-грануляту при асоціативних інвазіях свиней визначали за "Методикою визначення ефективності антгельмінтиків при гельмінтозах свиней" (Пономар С. І. та ін., 2001).
Кров для гематологічних, біохімічних і імунобіологічних досліджень від поросят відбирали із краніальної порожнистої вени на 7; 14; 21; 28 і 42 доби після введення препаратів. Копроовоскопічні дослідження проводили до дегельмінтизації та на 7 і 14 доби після введення антгельмінтних препаратів (Котельников Г. А., 1984).
У крові лабораторних тварин і свиней визначали: кількість еритроцитів і лейкоцитів підрахунком на сітці Горяєва лічильної камери; диференційний підрахунок лейкоцитів - мікроскопічним дослідженням мазків крові; концентрацію гемоглобіну - гемоглобінціанідним методом (з ацетонціангідридом) (Кондрахин И. П. и др., 1985).
У дослідах на щурах визначали гематокритну величину - мікрометодом з використанням мікроцентрифуги. На основі гематологічних показників крові визначали еритроцитарні індекси: кольоровий показник крові, середній об'єм еритроцита, середній вміст гемоглобіну в еритроциті, середню концентрацію гемоглобіну в еритроциті (Козинец Г. И. и др., 1997).
У сироватці крові свиней і лабораторних тварин, за допомогою стандартних наборів реактивів науково-виробничої фірми "SIMKO Ltd" та "Lachema" (Чехія) визначали активність аспартатамінотрансферази (АсАТ) (К. Ф. 2.6.1.1) і аланінамінотрансферази (АлАТ) (К. Ф. 2.6.1.2) - уніфікованим динітрофеніл-гідразиновим методом Райтмана-Френкеля; лужної фосфатази (ЛФ) (К. Ф. 3.1.3.1) - методом гідролізу динатрійфенолфосфату; загальних ліпідів - за реакцією з фосфованіліновим реактивом; тригліцеролів - омиленням гідроксидом калію (Меншиков В. В., 1987). Вміст загального білка визначали за допомогою рефрактометра RL3; співвідношення білкових фракцій сироватки крові - методом електрофорезу на плівках із ацетату целюлози; вміст загального та вільного холестеролу за методом М. А. Станкевіченє (1969); концентрацію глюкози - за допомогою набору ООО "Агат-Мед" (м. Москва, Росія), глюкозо-агат методом.
У сироватці крові поросят визначали загальний білок - за біуретовою реакцією, описаною В. Г. Колбом і В. С. Камишніковим (1982), активність холінестерази (ХЕ) [КФ. 3.1.1.8] - колориметричним методом (Меншиков В. В., 1987). Кількість Т - і В-розеткоутворюючих лімфоцитів у периферичній крові поросят визначали за методом Д. К. Новікова та В. І. Новікової (1979). Імуноглобуліни класів G і M визначали імуноферментним аналізом (ІФА) виробництва НВЛ "Гранум" (м. Харків).
Оцінку мутагенної дії прижиттєвих виділень, гомогенатів, інвазійних яєць, личинок гельмінтів та івермектинів проводили за тестом B. N. Ames et al., 1975. Для одержання екскреторно-секреторних метаболітів, гомогенату, інвазійних яєць аскарисів і трихурисів та личинок езофагостом дорослих гельмінтів інкубували в стерильному ізотонічному розчині хлориду натрію у термостаті при t+30°С. Мутагенну дію бровермектину 1% розчину та баймеку визначали у дозах 1; 0,1 та 0,01 мкг/чашку, а бровермектин-порошку та бровермектин-грануляту - у дозах 10,0; 1,0 та 0,1 мкг/чашку.
У модельних дослідах генотоксичну і цитотоксичну дію антгельмінтних препаратів та інвазійних яєць і личинок гельмінтів вивчали на суспензіях клітин кісткового мозку мишей і лімфоцитах свиней за методом "ДНК-комет" (N. P. Singh et al., 1988; в модифікації В. Hellman et al., 1995). Для вивчення даної дії препаратів було проведено 2 серії дослідів - на дослідних тваринах і на крові свиней in vitro. Було використано 80 мишей-самців лінії СВА 4-5-місячного віку і 5 поросят 2-3-місячного віку. Мутагенну дію бровермектину 1% та баймеку визначали у дозах 0,015; 0,03 та 0,045 мл/кг, а бровермектин-порошку та бровермектин-грануляту - у дозах 0,1; 0,2 та 0,3 г/кг. Вивчення генотоксичної і цитотоксичної дії інвазійних яєць і личинок гельмінтів було проведено на 72 мишах-самцях. З них було сформовано 12 дослідних груп, по 6 тварин у кожній. Дослідних тварин 9-и груп заражали в кількості - 5; 10 і 20 інвазійних яєць А. suum і T. suis та личинок Oe. dentatum на 1 г маси тіла тварини відповідно. Контролем слугували миші 3-х груп (інтактні). Аналіз мікропрепаратів проводили на люмінесцентному мікроскопі "Мікмед-2" фірми "ЛОМО" при х 600. Зображення комет на мікропрепаратах фотографували за допомогою цифрової фотокамери "Nikon Coolpix-4500".
Оцінку мутагенної дії інвазійних яєць і личинок гельмінтів за допомогою метафазного аналізу клітин кісткового мозку лабораторних тварин проводили за методом С. E. Ford (1956) та в дослідах на лейкоцитах крові поросят за методом P. S. Moorсhead et al. (1960). Каріотип клітин кісткового мозку вивчали на 72 білих щурах-самцях, із яких було сформовано 12 груп (n = 6), при тих же дозах зараження та добах дослідження як і при оцінці мутагенної дії інвазійних яєць та личинок гельмінтів за методом "ДНК-комет". Визначення змін каріотипу проводили на 7; 10; 14; 20; 21; 28; 30; 40; 42 та 60 доби після зараження. Мутагенну дію метаболітів визначали за частотою клітин зі структурними порушеннями хромосом у дослідах в порівняні з контролем. Оцінку стану хромосом на лейкоцитах крові поросят було проведено на 78 поросят великої білої породи 2-4-місячного віку, із яких було сформовано 13 груп (n = 6). Кількість заражень та час досліджень були такіж як і при клініко-експериментальних дослідженнях, але без введення антгельмінтних препаратів. Дослідження хромосом проводили за допомогою мікроскопа "Jenamed 2" (Carl Zeiss Jena) із х 1000. Облік аберацій хромосом здійснювали згідно з рекомендаціями ВООЗ (Бактон К., Эванс Г., 1975).
Виявлення мутагенної дії інвазійних яєць і личинок гельмінтів за мікроядерним тестом проводили за методикою W. Schmid (1976). Показники мікроядерного тесту визначали на тих же 72 білих щурах і в аналогічних кількостях інвазії та часу, що і при визначенні хромосомних аберацій методом метафазного аналізу клітин кісткового мозку. Результати досліду виражали у проміле.
Статистичну обробку отриманих даних та оцінку вірогідності проводили за параметричним критерієм Фішера-Стьюдента з використанням ІВМ-сумісного комп'ютера. Кореляційний коефіцієнт визначали за методикою, описаною І. А. Ойвіним (1960).
Похожие статьи
-
За темою дисертаційної роботи протягом 1997-2005 років було проведено 7 дослідів на коровах чорно-рябої породи, 3-5-ї лактацій, продуктивністю 3000-5000...
-
Дослідження за темою дисертаційної роботи виконувались протягом 19952006 років в Інституті тваринництва та в Інституті тваринництва центральних районів...
-
Робота виконана у період із 1997 по 2005 роки на базі наукової лабораторії кафедри анатомії і фізіології сільськогосподарських тварин Полтавської...
-
Дослідження проводились упродовж 2002-2005 років на базі кафедри патологічної анатомії Національного аграрного університету, патоморфологічного відділу...
-
Робота виконана впродовж 1990-2003 років у відділі профілактики хвороб птиці Інституту птахівництва УААН. Дослідження проводили на індиках кросу "Хідон"...
-
Дисертаційна робота виконана упродовж 19992008 рр. на кафедрі анатомії і гістології Харківської державної зооветеринарної академії; на базі проблемної...
-
Експериментальна частина досліджень виконана в 2002-2007 рр. на базі племрепродуктора ВАТ "Закарпатське племпідприємство". Об'єктом досліджень слугували...
-
Методи розведення свиней - Селекція у свинарстві
Розведення свиня селекційний свинарство Методи розведення -- це система підбору в свинарстві з урахуванням породної та лінійної належності тварин для...
-
Проведено аналіз літературних джерел вітчизняних і зарубіжних науковців з питань застосування різних підщеп та систем ведення підщепних кущів в...
-
Експериментальну частину досліджень проводили в умовах навчально-наукового виробничого тваринницького комплексу Кримського агротехнологічного...
-
Визначення пристосованості голштинської худоби різного походження до екологогосподарських умов степової зони України. Встановлено, що адаптація імпортної...
-
Планується для годівлісвиней концентрат ний тип годівлі свиней, повнораціонними комбікормами власного виробництва. Зернову групу кормових раціонів,...
-
Показник Значення Потужність комплексу, тис. голів 12 Період поросності, діб 115 Підсисний період, діб 35 Холостий період, діб 5 Коефіцієнт...
-
Остеометричний скелет ссавці Актуальність теми. Серед розмаїття біологічного матеріалу, який є об'єктом судової ветеринарної експертизи, суттєве значення...
-
Проведено аналіз літературних джерел з питань впливу способів основного обробітку грунту та добрив на агрохімічні, агрофізичні, мікробіологічні...
-
Клініко-епізоотологічні дослідження. При обстеженні з допомогою епізоотологічного, клінічного і лабораторних методів стада зі 130 корів одного...
-
Селекційні ознаки свиней, їх мінливість, взаємний зв'язок та успадкування - Селекція у свинарстві
Як відомо, кожна селекційна ознака виявляється у свиней відповідно до спадкових задатків, котрі закладені в генах. У тих випадках, коли успадкування...
-
Роботу виконано в Науково-виробничому центрі ветеринарної медицини птахівництва Луганського національного аграрного університету. Окремі дослідження...
-
Гиподерматоз необходимо дифференцировать от фурункулеза, при котором в центре созревшего фурункула возвышается небольшой флюктуирующий гнойничок,...
-
Отруєння кухонною сіллю, Отруєння селеном - Отруєння тварин різними речовинами
Частіше спостерігають у свиней і птахів, особливо при згодовуванні 'комбікормів з високим вмістом хлориду натрію. ВРХ отруюється в тих випадках, коли він...
-
Селекція соняшнику на підвищення вмісту олеїнової кислоти (огляд наукової літератури) На основі аналізу сучасного стану і результатів попередніх...
-
Роботу з агроекологічного обгрунтування розміщення виноградних насаджень проводили на території п'яти господарств Лівобережного Нижньодніпров'я: ВАТ...
-
Агрономічна оцінка сівозмін та обгрунтування чергування культур - Розробка сівозміни
Оптимізація структури посівних площ є основним, найбільш дешевим і екологічним засобом підвищення продуктивності агроекосистем. Певним набором культур,...
-
Основні дослідження з теми дисертації проводили з 1996 по 2005 рік в лабораторії нематології Інституту захисту рослин УААН, лабораторії захисту цукрових...
-
Методика отримання та застосування препаратів Для визначення концентрації ВМ у рослині був використаний метод атомно-абсорбційного аналізу (ААА) [2]....
-
КОРМЛЕНИЕ СВИНЕЙ - Особенности кормления свиней и мини-пигов
Кормление хряков-производителей. Кормление хряков должно быть направлено на создание в течение круглого года условий, обеспечивающих физиологическое...
-
Лікування та його обгрунтування - Папіломатоз вим'я у корови (papillomatoza uberis)
Боротьба з пухлинними захворюваннями є дуже складною. Заходи профілактики новоутворень обмежуються лише раннім виявленням пухлин у тварин з наступним їх...
-
Прежде чем приступить к лечению ветспециалист должен выяснить и устранить причины, вызвавшие у поросят рахит. Лечение рахита должно быть комплексным. Для...
-
Как известно, существует два типа кормления свиней жидкое и сухое. О преимуществах этих типов споры никогда не утихнут. Сегодня в мире сухой тип...
-
Профилактика, Ветеринарно-санитарная экспертиза - Отравление поваренной солью у свиней
Профилактика заключается в постоянном контроле за обеспечением животных поваренной солью, чтобы не допустить солевого голодания. При скармливании свиньям...
-
Дифференциальный диагноз, Лечение, Ветеринарно-санитарные мероприятия - Цистицеркоз (финноз) свиней
Цистицеркоз (финноз) свиней следует дифференцировать от саркоцистоза (протозойное заболевание). Капсулы саркоцист по внешнему виду сходны с цистицерками....
-
Складання плану освоєння розробленої сівозміни та ротаційної таблиці - Розробка сівозміни
Після складання можливих варіантів сівозміни, потрібно обрати найбільш досконалий варіант (головний), щоб на основі даних по розміщенню культур у полях...
-
Половая и физиологическая зрелость маток и хряков. Половая зрелость у молодых свинок наступает в 6-7 мес. (5-8), в зависимости от скороспелости породы,...
-
Патологоанатомические изменения, Лабораторная диагностика - Цистицеркоз (финноз) свиней
Сведения о патологоанатомических изменениях в трупах свиней при цистицеркозе малочисленны. Отмечаются атрофия тканей под давлением развивающихся...
-
Патогенез, Клинические признаки болезни - Цистицеркоз (финноз) свиней
Болезнетворное влияние цистицеркусов в основном проявляется в период их миграции. Множество онкосфер, проникая в слизистую кишечника и мелкие капилляры,...
-
Динаміка росту дослідних груп тварин. Вивчався ріст молодняку на всіх етапах постнатального розвитку, починаючи від дня народження до 18 місяців. Для...
-
Групи тварин Кістки Лопатка Плечова Променева Ліктьова Тазова Стегнова Велика гомілкова Кріль-заєць D1 * , D2 * , D5 ** D2 ** Кріль-байбак D5 ** D5 * D5...
-
Польові дослідження виконували на Носівській селекційно-дослідній станції Чернігівського ІАПВ УААН у тимчасових дослідах протягом 2002-2004 рр. Грунт...
-
Основной особенностью семилетнего развития эпизоотического процесса АЧС в сильно структурированном свиноводстве Российской Федерации является наблюдаемая...
-
12) Для установления размера шаговых (технологических) групп свиней вначале рассчитываем соответствующую группу свиноматок и ремонтных свинок, отобранных...
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕНЬ - Асоціативні інвазії у свиней (епізоотологія, розробка, фармако-токсикологічне та терапевтичне обгрунтування щодо застосування бровермектин-грануляту)