Методика изучения отдельных понятий темы с использованием учебного эксперимента и постановки проблемы - Методика изучения темы "Теория электролитической диссоциации"
Фрагменты урока "Электролитическая диссоциация"
Цель урока: расширить знания учащихся об электропроводности, усвоить следующие понятия "электролит", "неэлектролит", "гидратированный ион", "электролитическая диссоциация", "механизм диссоциации"; расширить представления о веществах и химических реакциях на основе знаний об электропроводности, реакциях ионного обмена; о зависимости свойств веществ от их состава и строения; научить учащихся правильному обращению с различными веществами и работе с приборами по определению электропроводности веществ.
Задачи урока:
- -образовательная: вооружить учащихся знаниями о сущности процесса электролитической диссоциации, обучить основным понятиям темы, сформировать понятие о механизмах и условиях протекания процесса, используя понятия электролит, неэлектролит. -развивающая: изучаемая тема создает теоретическую базу для дальнейшего изучения химии, служит для переосмысления уже пройденной части курса. Тема углубляет и расширяет знания о свойствах веществ на ионном уровне. -воспитательная: сформировать научное мировоззрение по вопросам строения и свойствам веществ, диссоциирующих на разноименно заряженные ионы. Раскрыть идею развития в познании физико-химических процессов по мере накопления новых фактов и на основе эксперимента.
Метод урока: объяснение с элементами беседы на основе демонстрационного эксперимента.
Оборудование: прибор для определения электропроводности, вода, сухая соль NaCl, сахар, ледяная уксусная кислота, металлы, неметаллы, стаканчики, сухая салфетка, динамическая модель "Механизм электролитической диссоциации".
Ход урока:
Организационный момент.
Объяснение нового материала.
Учитель начинает урок с вопросов.
Ребята, что такое электрический ток?
Каковы условия прохождения электрического тока?
Получив ответы на эти вопросы, учитель ставит следующий вопрос.
Как определить: Проводит вещество электрический ток или нет? Учитель объясняет устройство прибора и технику работы с ним.
Чтобы определить электропроводность веществ в лабораторных условиях необходим прибор, измеряющий электропроводность. Прибор, измеряющий электропроводность представляет собой 2 электрода, подсоединенных к гальванометру и источнику тока. При помощи кнопки мы можем регистрировать значение электропроводности. Для проведения опыта возьмем следующие вещества: металл, неметалл, дистиллированную воду, соль NaCl твердую и ее водный раствор, а также СН3СООН ледяную и ее раствор, а также раствор NaCl в СН3СООН. Результаты опыта занесем в таблицу:
Электропроводность веществ
|
Вещества |
Электропроводность |
|
1. Металл |
Да |
|
2. Неметалл |
Нет |
|
3. Н2О диет. |
Нет |
|
4. NaCl (тверд.) |
Нет |
|
5. NaCl (раствор) |
Да |
|
6. Сахар (тверд.) |
Нет |
|
7. Сахар (раствор) |
Нет |
|
8. СН3СООН (лед.) |
Нет |
|
9. СН3СООН (раствор) |
Да |
|
10. NaCl в СН3СООН |
Нет |
Учитель анализирует совместно с учащимися результаты опытов. Итак, мы посмотрели опытным путем, что некоторые вещества, например, металлы, NaCl (раствор), СН3СООН (раствор) проводят электрический ток, а остальные - не Проводят электрический ток. Тем самым мы разделили вещества на 2 большие группы - проводящие и непроводящие электрический ток.
Еще в 19 веке М. Фарадей, занимаясь этим вопросом, разделил вещества на электролиты и неэлектролиты.
Электролиты - вещества, растворы которых проводят электрический ток. К ним относят: (NaCl, CH3COOH и др. - проводники 2 рода, металлы - это проводники 1 рода).
Неэлектролиты - вещества, растворы которых не проводят электрический ток (сахар, этиловый спирт).
Учитель ставит проблемный вопрос. А как вы считаете, почему одни вещества проводят в растворе электрический ток, а другие не проводят?
Логическая цепочка рассуждений может быть следующей. Давайте вспомним условия прохождения тока?
- Наличие свободных электронов.
Какие вещества имеют в кристаллической решетке свободные электроны?
- Металлы.
Значит, причину прохождения тока у металлов мы выяснили - это наличие свободных электронов. А как же другие вещества? По какой причине они проводят электрический ток и являются электролитами.
- Имеются другие заряженные частицы?
Да, переносчиками заряда являются ионы.
А почему NaCl (тверд.) не проводит электрический ток, ведь NaCl состоит из ионов?
- ионы есть, но они находятся в узлах кристаллических решеток, поэтому перемещаться свободно не могут.
А как же в водном растворе ведут себя ионы NaCl?
Вероятно, ионы поваренной соли в водном растворе могут свободно перемещаться и переносить заряды, то есть ионные вещества в растворе распадаются на ионы, что позволяет проводить электрический ток.
Почему же раствор хлорида натрия в уксусной кислоте не проводит электрический ток?
В растворе уксусной кислоты соль не распадается на ионы.
Что из этого следует?
Вода обладает особыми свойствами; воздействуя на ионные соединения, они распадаются на ионы. Уксусная кислота такими свойствами не обладает.
Учитель подводит промежуточный итог рассуждения. Наличие электропроводности у растворов ионных соединений можно объяснить исходя из строения этих веществ и особых свойств воды как растворителя. Учитель просит обсудить электропроводность уксусной кислоты.
Является ли уксусная кислота ионным соединением?
Нет, уксусная кислота соединение молекулярного строения, поэтому это вещество не проводит электрический ток.
Какой можно было бы сделать прогноз?
- СН3СООН - неэлектролит.
А почему же раствор СН3СООН проводит электрический ток? Ведь молекулы не могут быть переносчиками заряда, тогда как же переносится заряд в растворе уксусной кислоты?
Значит, возникновение электропроводности в водном растворе определяется опять-таки влиянием воды. В водном растворе образуются ионы водорода и кислотного остатка. Именно вода принимает участие в образовании ионов.
Учитель с помощью динамической модели с изображением кристаллической решетки поваренной соли NaCl, рассматривает механизм диссоциации ионных соединений под действием молекул воды. К узлам кристаллической решетки, где находятся ионы Na+, C1-, к ионам подходят диполи молекул воды противоположно заряженным полюсом и отрывают их от кристаллической решетки, относят в сторону, окружая со всех сторон с образованием гидратированных ионов:
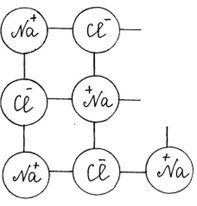


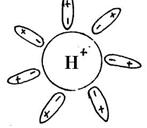


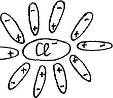
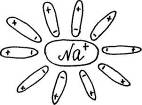
Далее с помощью динамической модели с изображением молекулы уксусной кислоты учитель рассматривает механизм диссоциации полярных ковалентных соединений под действием молекул воды.
Следующий этап объяснения включает уточнение механизма диссоциации, ознакомление с уравнениями электролитической диссоциации, определением перечня электролитов и неэлектролитов и т. д.
Для закрепления темы проводится блиц-опрос. Учитель задает вопросы и получает немедленный ответ на него.
- 1. Как называют вещества, проводящие электрический ток? 2. Как называют вещества, не проводящие электрический ток? 3. Почему ионные соединения, состоящие из заряженных частиц, вкристаллическом виде не проводят электрический ток? 4. Соединения, с каким видом связи, являются электролитами в расплавленном и растворенном состоянии? 5. Как диссоциируют ионные соединения? 6. Какой тип кристаллической решетки характерен для электролитов? 7. Какие классы неорганических соединений относятся к электролитам? 8. Что называют электролитической диссоциацией? 9. Назовите известные вам неэлектролиты? 10. Влияет ли температура на электропроводность веществ? 11. Почему различные металлы по-разному проводят электрический ток? 12. Являются ли металлы электролитами? 13. Как опытным путем доказать проводимость электролита?
После опроса подводятся итоги, выставляются оценки за участие на уроке.
Домашнее задание: § 35 (учебник О. С.Габриеляна) упр. 1-6.
Похожие статьи
-
Наглядность и эксперимент - Методика изучения темы "Теория электролитической диссоциации"
Наглядность и эксперимент - это неотъемлемые средства обучения при изучении химии в школе Для проведения эксперимента по теме необходим прибор для...
-
Основные понятия темы - Методика изучения темы "Теория электролитической диссоциации"
Электролитический диссоциация электропроводность Основные понятия темы рассмотрим на примере учебника О. С. Габриеляна. Автор в каждом параграфе дает ряд...
-
Вопрос об электролитической диссоциации веществ изучается в 8 классе в теме "Растворение. Растворы. Свойства растворов электролитов". Электролитическая...
-
Физика - электрический ток (упорядоченное движение электронов, проводники первого рода и т. д.). Химия - Периодический закон и система химических...
-
Место и значение темы в курсе химии В настоящее время выбор учебников по химии, рекомендованных и допущенных Министерством образования Российской...
-
Комплект состоит из четырех обобщающих схем (ОС): OC-I. Электролитическая диссоциация. ОС-П. Кислоты, основания, амфотерные гидроксиды, соли как...
-
Электролитическая диссоциация - Обобщающие схем-конспекты по теме "Электролитическая диссоциация"
Модульная программа "Электролитическая диссоциация" Интегрирующая цель. В результате работы над учебными элементами (УЭ-1 - УЭ-7): - закрепить знания по...
-
Количественно процесс диссоциации вещества в растворе можно оценить по степени диссоциации а. Ее рассчитывают как отношение числа молекул электролита,...
-
В молекуле воды связи О--Н полярны, электронная плотность этих связей смещена к атому кислорода как к более электроотрицательному. Вследствие этого на...
-
ПО ОРГАНИЧЕСКОЙ ХИМИИ Характерными чертами демонстрационного эксперимента в органической химии являются следующие: - Эксперимент в преподавании...
-
Протистами ( Protista ) называют организмы, тело которых состоит из одной-единственной эукариотической клетки. Другой термин, употребляемый для...
-
Изучение темы "Спирты" имеет важное значение в формировании у учащихся основных понятий органической химии. На материале этой темы прежде всего...
-
На уроках химии при изучении вопросов, связанных с производственной тематикой, уделяется большое внимание не только рассмотрению химических процессов,...
-
Карбоновые кислоты. Цели. Рассмотреть строение, свойства, получение и применение карбоновых кислот; развить навыки самостоятельной работы учащихся с...
-
Теоретическую часть своей курсовой работы мы опробировали на практике в СОШ №3. Что бы это все успешно осуществилось нами был составлен план действий,...
-
Цели. Воспитательные . Воспитание коллективизма, экологической культуры, бытовой компетентности учащихся. Развивающие: Развитие умения делать выводы,...
-
При изучении общей характеристики галогенов нужно постоянно опираться на уже усвоенные учащимися представления о взаимосвязи между химическими элементами...
-
В папку с материалами для контроля знаний должны входить файлы с экзаменационными вопросами, вопросами для самоконтроля и инструкция для студентов по...
-
Надо иметь в виду, что учитель не формирует учебную деятельность непосредственно. В практике обучения учебная деятельность формируется в ходе решения...
-
Гипотеза нашего исследования: Можно предположить, что использование тестовых заданий в процессе оценивания учебных достижений младших школьников будет...
-
Тема "Классы неорганических веществ" № п/п Число Тема урока 1 07.03. Кислотные оксиды 2 14.03. Общие свойства кислот: взаимодействие с индикаторами и...
-
Решение задач способствует осуществлению связи теории с практикой, глубокому пониманию и закреплению изучаемого материала, а также привитию учащимся...
-
Методические разработки по теме: "Моносахариды" - Модульное обучение в школе
Урок по теме: "Глюкоза -- представитель моносахаридов" Тема урока: "Глюкоза - представитель моносахаридов". Цели урока: 1. Расширение и углубление знаний...
-
Цель урока: закрепить полученные знания об альдегидах, ознакомить учащихся с некоторыми способами получения альдегидов (общими и специфическими),...
-
Тип урока. Изучение нового материала. Вид урока. Беседа с использованием учебного химического эксперимента. Цели. Обучающие: изучить сущность химических...
-
Исследование было проведено нами на базе МОУ СОШ №10 с углубленным изучением отдельных предметов г. Щелкова. Для участия в эксперименте нами были выбраны...
-
Сущность и содержание понятий "личностные универсальные учебные действия", "гражданственность" и "патриотизм" В последние годы внимание российского...
-
Цель: Закрепление нового материала. 1) В чем разница ресурсов и факторов производства? Ответ: Ресурсы - все что угодно, факторы производства - это те...
-
Проверка и оценка знаний учащихся на уроке - завершающий этап обучения. Основная цель этой составной части урока - определение качества усвоения...
-
В списке чатов выберите группу и щелкните маркер в поле История . В раскрывающемся списке установите дату, за которую хотите просмотреть сообщения, и...
-
Грибы играют большую роль в круговороте веществ в природе, в разложении остатков животных и растений, попадающих в почву, образовании в почве...
-
Как показывают последние социологические исследования, в российском обществе растет потребность в самостоятельно мыслящих образованных выпускниках школ,...
-
ЛИТЕРАТУРА - Использование элементов экономических знаний при изучении производства серной кислоты
1. Карасева О. Ю. О способах активации мыслительной деятельности. - // Химия в школе. - 2005. - №10. - С.13-17. 2. Гузик Н. П. "Обучение органической...
-
Овладение общими учебными умениями и навыками, развитие интереса к самостоятельной учебной работе, формирование опыта творческой деятельности - все это...
-
1. Заполните таблицу "Сравнение семян двудольных и однодольных растений 2. Сравните части семени и проростка. Покажите стрелками на схеме, из каких...
-
Одной из основных тем 3-4 класса является изучение частей речи. Учащиеся при изучении имени существительного, имени прилагательного, глагола, испытывают...
-
Урок №1. "Семя" Пословицы и поговорки: 1. Земля кормит людей как мать детей. 2. Забота и на песке колос вырастит. 3. У кого весной простой, у того амбар...
-
Литература - Методические особенности при изучении темы "Соцветия" на уроках биологии
1. Биологические экскурсии/И. В. Измайлов, В. Е. Михлин, Э. В. Шашков и др. -- М.: Просвещение, 1983. 2. Бобров Р. Н. Зеленый патруль: Пособие для...
-
Каждый из нас весной и в начале лета наверняка не раз видел довольно крупных (длиной 2-- 2,5 см) светло-коричневых жуков цилиндрической формы с...
-
Основная идея использования домашнего эксперимента (ДЭ) разрабатывалась в работах И. И. Балаева [2], серия статей в журнале "Химия в школе" (1966. - №6....
Методика изучения отдельных понятий темы с использованием учебного эксперимента и постановки проблемы - Методика изучения темы "Теория электролитической диссоциации"