Введение, Краткая история учения о биологическом окислении - Биологическое окисление
Биологическое окисление - это совокупность окислительных процессов, протекающих в живых организмах. Биологическое окисление выполняет ряд важных Функций:
- - энергетическая функция - окислительные процессы снабжают биологические процессы энергией. - биосинтетическая функция - путем окислительных реакций могут синтезироваться новые вещества, необходимые для организма. - обезвреживающая (детоксикационная) функция - путем окислительных реакций многие вещества лишаются своей токсичности.
По современным представлениям процесс окисления веществ сводится к потере ими электронов. Вещество, теряющее электроны - донор электронов, вещество, присоединяющее электроны - акцептор электронов. Все живые организмы, в зависимости от вида конечного акцептора электронов, делятся на аэробные и анаэробные организмы. У аэробов конечным акцептором электронов служит кислород. У анаэробных организмов электроны переносятся не на кислород, а на какие-то другие вещества
Краткая история учения о биологическом окислении
На первых этапах изучения процессов окисления были предложены Теории Активации кислорода, в которых предполагался какой-то механизм активации кислорода, поскольку кислород в организме является более активным окислителем, чем вне организма. К теориям этого направления относится, в частности, Перекисная теория А. Н. Баха (1847 г.). Согласно ей, в организме есть вещества, которые, взаимодействуя с молекулярным кислородом, образуют перекисные вещества, в которых кислород становится более активным.
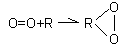
Впоследствии кислород в составе перекиси окисляет многие субстраты в организме. В результате к окисленному веществу присоединяется кислород. Эта теория носит частный характер.
Позже (1911 г.) возникла Теория дегидрирования А. В. Палладина. Согласно ей, вещества окисляются не путем присоединения кислорода, а путем потери атомов водорода. В первую анаэробную фазу окисления происходит перенос атомов водорода с субстрата (RH2) на акцептор (X) при участии ферментов дегидрогеназ:
RH2 + X = R + XH2
Во вторую аэробную стадию окисления атомы водорода переносятся с восстановленного акцептора (ХН2) на кислород. Акцептор при этом окисляется и повторно участвует в дегидрировании субстрата
XH2 + O2 = X + H2O
По теории Палладина допускалось участие в окислительных процессах кислорода воды. Теория Палладина более универсальна и положена в основу современных представлений о биологическом окислении.
Процессы биологического окисления могут протекать в разных отсеках клетки. Принято выделять 2 вида окисления: внутримитохондриальное и внемитохондриальное.
Внутримитохондриальное окисление протекает на внутренней мембране митохондрий, выполняет энергетическую функцию.
Внемитохондриальное Окисление протекает в цитозоле, ЭПС, пероксисомах и на внешней мембране митохондрий. Оно в основном участвует в биосинтетических и детоксикационных процессах.
В этих видах окислениях участвует большое количество ферментов, коферментов, переносчиков электронов. К ферментам участвующим в биологическом окислении относятся дегидрогеназы, оксигеназы, пероксидазы.
Дегидрогеназы
В зависимости от состава небелковой части дегидрогеназы делят на никотинамидзависимые и флавиновые ферменты.
Никотинамидзависимые дегидрогеназы
Никотинамидзависимые дегидрогеназы - сложные белки, состоящие из белковой и небелковой части. Белковая часть дегидрогеназ определяет их специфичность, имеет молекулярную массу, равную 70 тыс. д. В активном центре дегидрогеназ присутствуют SH группы. Кофермент дегидрогеназ представлен динуклеотидами НАД и НАДФ.
НАД - никотинамидадениндинуклеотид
В состав НАД входят два нуклеотида:
- 1. аденин - рибоза - Н3 РО4 2. никотинамид - рибоза - Н3 РО4
НАДФ - никотинамидадениндинуклеотидфосфат.
Состав НАДФ:
- 1. аденин - рибоза (Н3 РО4) - Н3 РО4 2. никотинамид - рибоза - Н3 РО4
Коферменты НАД и НАДФ определяют третичную структуру дегидрогеназ, придают активность белковой части фермента и участвуют в переносе кислорода. В организме встречаются дегидрогеназы, активные только в присутствии НАД: лактатдегидрогеназа, малатдегидрогеназа. Имеются ферменты, где коферментом является только НАДФ: глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа. Для фермента глютаматдегидрогеназы в качестве кофермента возможно использование как НАД, так и НАДФ,
Общий вид реакции, катализируемой НАД (НАДФ) - дегидрогеназами имеет вид:
Субстрат Н2 + кофермент (НАД, НАДФ)> субстрат + НАДН2 (НАДН2), т. е. водород отщепляется от окисляемого субстрата, а кофермент при этом восстанавливается.
НАД и НАДФ непрочно связаны с белковой частью фермента. В данной реакции непосредственным акцептором протонов и электронов в составе НАД или НАДФ является часть кофермента - Никотинамид.
Механизм восстановления кофермента
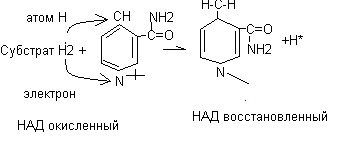
В последующем НАДН2 используется в энергетических процессах, а НАДФН2 используется в качестве источника водорода для восстановительных синтезов (синтез жирных кислот, стероидных гормонов, холестерина).
В составе НАД и НАДФ содержится витамин РР.
Витамин РР, никотиновая кислота, противопеллагрический витамин
Витамин РР содержится в основном в злаках. Суточная потребность в нем составляет 10 мг.
Биологическая роль РР - входит в состав НАД и НАДФ, участвует в процессах биологического окисления. Авитаминоз проявляется заболеванием пеллагрой (шершавая кожа). К ее симптомам относятся дерматит, слабоумие (деменция), расстройства функций кишечника (диарея) - болезнь "трех Д".
Флавопротеиды - флавиновые дегидрогеназы
Это сложные белки, состоящие из белка и небелковой части, представленной флавинмононуклеотидом (ФМН) или флавинадениндинуклеотидом (ФАД). Белковая часть флавопротеидов имеет большую молекулярную массу около 200 тыс. д. и прочно связывается с небелковой частью.
ФМН - флавинмононуклеотид, состоит из флавина, рибитола, Н3РО4.
ФАД - флавинадениндинуклеотид, включает флавиновый и адениловый нуклеотиды:
- 1. флавин - рибитол - Н3РО4. 2. аденин - рибоза - Н3РО4.
Общий вид реакции с участием флавопротеидов:
1 стадия
СубстратН2 + ФМН (ФАД) флавопротеид субстрат + ФМНН2 (ФАДН2)
2 стадия флавопротеид
ФМНН2 (ФАДН") + Х ФМН (ФАД) +ХН2
Акцептор
В качестве субстратов для флавопротеидов служат янтарная кислота, активные формы жирных кислот. В этом случае флавопротеиды являются первичными акцепторами протонов и электронов для этих веществ. Донором водорода для флавопротеидов может также служить молекула НАДН2. В этом случае флавопротеиды являются промежуточными акцепторами протонов и электронов. В качестве акцепторов электронов для флавопротеидов могут являться убихинон (во внутримитохондриальном окислении) или непосредственно кислород (во внемитохондриальном окислении). Непосредственным переносчиком протонов и электронов в составе флавопротеидов служит флавин.
Схема восстановления флавина:
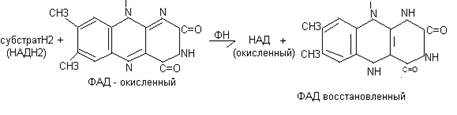
В составе ФМН и ФАД содержится витамин В2
Витамин В2, рибофлавин, витамин роста
Рибофлавин включает флавин и рибитол. Рибофлавин распространен в оболочке злаков, в дрожжах. Суточная потребность в нем составляет 1-2 мг. Биологическая роль - входит в состав ФМН и ФАД, участвует в биологическом окислении.
Авитаминоз проявляется в виде дерматита, катаракты, анемии, поражении сердечной мышцы
Убихинон (КоQ)
Убихинон - небелковое жирорастворимое вещество, перемещающееся во внутренней мембране митохондрий. Его роль сводится к переносу электронов и протонов от флавопротеидов на цитохромы.
Общий вид реакции с участием убихинона:
ФМНН2 + КоQ >ФП ФМН (окисл) + КоQН2 (восст)
Механизм восстановления убихинона:
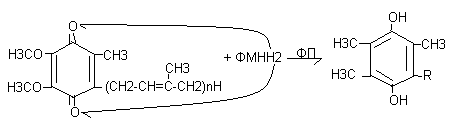
Цитохромы
Цитохромы - гемсодержащие белки. Различные виды цитохромов обозначают латинскими буквами А, А3, С, С1, В, В5, Р450. Цитохромы отличаются строением белковой части, структурой гема, оптическими свойствами, величиной окислительно-восстановительного потенциала. Их роль заключается в переносе электронов за счет окисления и восстановления содержащегося в их составе атома железа: Fe2+ Fe3+
Большинство цитохромов переносят электроны друг от друга в зависимости от величины их окислительно-восстановительного потенциала. И только один комплекс - цитохромоксидаза способен переносить электроны непосредственно на кислород. В связи с этим цитохромоксидаза - конечный (терминальный) участок в цепи переноса электронов. Цитохромоксидаза включает в себя два гема двух цитохромов цА и цА3, ионы меди, 6 полипептидных цепей, имеет молекулярную массу 450 тысяч дальтон. Цитохромоксидаза может переносить 4 электрона непосредственно на молекулу О2 С образованием воды.
Оксигеназы
Оксигеназы - это ферменты, катализирующие окисление веществ путем присоединения одного или двух атомов кислорода. Различают монооксигеназы и диоксигеназы. Они участвуют во внемитохондриальном окислении (смотри дальше)
Пероксидазы
Пероксидазы - это ферменты, катализирующие окислительные реакции с участием пероксидных соединений во внемитохондриальном окислении (смотри дальше).
Биологический фосфорилирование окисление химический
Похожие статьи
-
Внемитохондриальное окисление - Биологическое окисление
Внемитохондриальное окисление протекает в ЭПС, пероксисомах, на внешней мембране митохондрий, цитозоле. Этот вид окисления в разных тканях расходует...
-
Введение, История открытия - Витамин Н, биотин
В составе пищи, которую мы едим, содержаться различные вещества, необходимые для нормальной работы всех органов, способствующие укреплению организма,...
-
Внутримитохондриальное окисление. Окислительное фосфорилирование - Биологическое окисление
Митохондрии поглощают до 80-90% всего потребляемого клеткой кислорода. Все компоненты внутримитохондриального окисления встроены во внутреннюю мембрану...
-
Эволюционная биология. История эволюционного учения - Биология как естественная наука
Эволюционная биология - раздел биологии, изучающий происхождение видов от общих предков, наследственность и изменчивость их признаков, размножение и...
-
Введение, Понятие "Биологическая мембрана" - Функции биологических мембран. Ионные каналы мембран
Тема моего сегодняшнего реферата "Функции биологических мембран. Ионные каналы мембран". Тема очень увлекательная и в то же время познавательная. Ведь,...
-
Введение - История развития представлений о биосфере
Биосфера -- населенная жизнью оболочка Земли, состав, структура и энергетика которой в существенных чертах обусловлены прошлой или современной...
-
Введение - Аналогия и моделирование в биологических исследованиях
Биология - наука, добывающая сведения о живой природе разными методами исследований. Метод (греч. Methodos - "путь к чему-либо") - это способ достижения...
-
Введение, Биологическая роль углеводов - Обмен углеводов в организме животных
Углеводы, класс органических веществ, которые характеризуются тем, что при одной альдегидной или кетонной группе имеют несколько спиртовых групп...
-
"Наша способность к самообмену по поводу работы собственного мозга почти безгранична главным образом потому, что часть, о которой мы можем сообщить,...
-
История возникновения учения о симметрии - Симметрия в природе
Симметрия является фундаментальным свойством природы, представление о котором, как отмечал академик В. И. Вернадский, "слагалось в течение десятков,...
-
ИСТОРИЯ ВОЗНИКНОВЕНИЯ УЧЕНИЯ О СИММЕТРИИ - Основы учения о симметрии
Симметрия является фундаментальным свойством природы, представление о котором, как отмечал академик В. И. Вернадский, "слагалось в течение десятков,...
-
Биологические катализаторы - Питательные вещества
В основе всех жизненных процессов лежат тысячи химических реакций. Они идут в организме без применения высокой температуры и давления, т. е. в мягких...
-
Введение - Питательные вещества
Нормальная деятельность организма возможна при непрерывном поступлении пищи. Входящие в состав пищи жиры, белки, углеводы, минеральные соли, вода и...
-
Введение - Строение системы пищеварения
Для нормальной жизнедеятельности организм любого человека необходимо регулярное поступление пищи, представляющей совокупность органических и...
-
ВВЕДЕНИЕ - Биологическая характеристика черноморской хамсы
Черноморская хамса (анчоус) - Engraulis encrasicolus ponticus ( Alexandrov ), по таксономическому положению, представляет собой один из видов...
-
Введение, Анатомия в Древней Руси - История развития отечественной анатомии
Анатомия человека - наука, изучающая форму и строение тела человека в связи с его функциями и закономерностями развития. Изучая строение отдельных...
-
История развития учений о воспалении - Теории воспаления
Гиппократ считал воспаление результатом локального избытка одного из соков организма (IV век до н. э.). Феноменологически, основные признаки воспаления...
-
Развитие микробиологии определялось конкретными историческими условиями: развитием социально - экономической основы общества, обусловленным ростом...
-
Введение - Биологический возраст и методы его оценки
Возрастная норма и норма старения. Норма в физиологии и медицине - общее обозначение равновесия организма человека, его органов и функций,...
-
Лещ обыкновенный (Abramis brama) относится к семейству карповых, имеет огромное хозяйственное значение. Этот вид является акклиматизантом и благодаря...
-
ВВЕДЕНИЕ - Основы учения о симметрии
Под симметрией (от греч. symmetria -- соразмерность) в широком смысле понимают правильность в строении тела и фигуры. Учение о симметрии представляет...
-
Введение - Роль белков в организме
Нормальная деятельность организма возможна при непрерывном поступлении пищи. Входящие в состав пищи жиры, белки, углеводы, минеральные соли, вода и...
-
Биология и ее предмет. История биологии - Биология как естественная наука
Биология (от греч. bios - жизнь, logos - наука) - наука о жизни, об общих закономерностях существования и развития живых существ. Предметом ее изучения...
-
Термин "аллергия" был введен венским педиатром Клеменсом Фон Пирке в 1906 г. Он заметил, что у некоторых из его пациентов наблюдаемые симптомы могли быть...
-
Введение - Дыхательная система человека
Кислород находится в окружающем нас воздухе. Он может проникнуть сквозь кожу, но лишь в небольших количествах, совершенно недостаточных для поддержания...
-
Введение, Белки - Анализ пищевых веществ, необходимых для организма человека
Организм человека состоит из белков (19,6 %), жиров (14,7 %), углеводов (1 %), минеральных веществ (4,9 %), воды (58,8 %), Он постоянно расходует эти...
-
Введение в биологию - Введение в физиологию
Биология (от греч. bios-жизнь, logos-понятие, учение) - это наука, изучающая живые организмы. Развитие этой науки шло по пути последовательного упрощения...
-
Ферменты (от латинского слова fermentum - закваска) - белки, которые обладают каталитической активностью и характеризуются очень высокой специфичностью и...
-
Строение листа (рисунок Ф. Унгера) - Учение о растительной клетке
Весьма сложные процессы равномерного распределения ядерного вещества, наблюдаемые при делении клеток у высших растений, ускользнули от внимания этих...
-
История открытия, Биологическая роль - Свойства холестерина
В 1769 году Пулетье де ла Саль получил из желчных камней плотное белое вещество ("жировоск"), обладавшее свойствами жиров. В чистом виде холестерин был...
-
Введение - Отражение истории формирования фармацевтических знаний в музейных коллекциях
Большой интерес представляют китайская медицина и фармация. Собственная научная медицина и фармация возникли в Китае примерно за 1000 лет до нашей эры....
-
Введение, История появления раздельного питания - Раздельное питание. Преимущества и недостатки
Еда - существенная часть сбалансированной диеты". Фран Лебовиц Сейчас раздельным питанием увлекаются очень многие. Кто-то таким образом пытается...
-
Методы биологических исследований - Аналогия и моделирование в биологических исследованиях
Когда мы говорим о биологии, мы говорим о науке, которая занимается исследованием всего живого. Все живые существа, включая ареал их обитания, изучаются....
-
Относительно проблемы происхождения и эволюции человека существует множество теорий появления человека на Земле. В настоящее время большинство ученых...
-
Введение - Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК
Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК (ГВОЗДЕВ В. А., 1999), БИОЛОГИЯ Рассмотрена роль метилирования ДНК...
-
Введение - Биофизика мышечного сокращения
Физика и биология, на первый взгляд, довольно далекие друг от друга науки. Но это только на первый взгляд. В действительности же в этих науках есть много...
-
Биологические ритмы или биоритмы - это более или менее регулярные изменения характера и интенсивности биологических процессов. Способность к таким...
-
Одна из основ устойчивости биосферы - наличие резервов и запасных решений в отношении любой задачи, которые ставит перед живыми организмами природная...
-
Вклад В. Н. Беклемишева - История развития представлений о биосфере
Российский зоолог, основатель научной школы паразитологов. Одной из первых работ В. Н. Беклемишева было построение естественной системы организмов....
-
Белким -- высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединенных в цепочку пептидной связью. В живых организмах...
Введение, Краткая история учения о биологическом окислении - Биологическое окисление