РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ - Аллотрансплантаты в реконструктивной хирургии сосудов
В работе представлен анализ 7-летних результатов использования артериальных и венозных аллографтов "влажного" хранения в реконструктивной хирургии сосудов.
Наиболее часто при атеросклерозе были поражены аорто-подвздошный сегмент и поверхностная бедренная артерия (рис. 4).
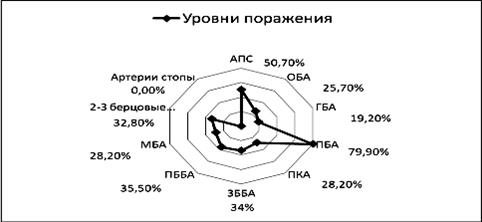
Рисунок 4. Частота уровней поражения артерий нижних конечностей у больных с атеросклероз (I группа). |
У пациентов с комбинированным поражением чаще (66,2%) поражались подколенная артерия и артерии голени (рис. 5). Среднее число пораженных сегментов у больных диабетом было достоверно выше, чем у пациентов с атеросклерозом (Р <0,01).
У 55,9% пациентов с диабетом на момент обращения в клинику наблюдались признаки поражения мягких тканей стопы в виде трофических язв, а у 14,5% - флегмона стопы.
Треть больных (181) в анамнезе перенесли различные реконструктивные операции на магистральных сосудах, причем у 110 (60,8%) выполнена одна операция, у 42 (23,2%) - две и у 29 (16,0%) - три и более операции. У 97 (16,3%) из 596 пациентов в прошлом были выполнены реваскуляризирующие операции на артериях других анатомофункциональных сосудистых бассейнах (АФСБ).
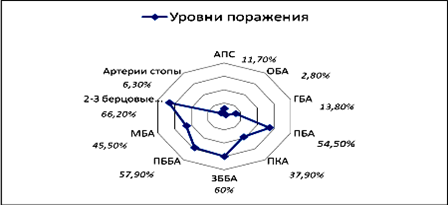
Рисунок 5. Частота уровней поражения артерий нижних конечностей у больных с комбинированным поражением (атеросклероз+сахарный диабет, II группы). |
Также нужно отметить, что у 63% пациентов с атеросклеротическим и у 90% больных с комбинированным поражением артерий нижних конечностей исходно имелась критическая степень хронической или острой ишемии конечностей. Большинству из них в разных клиниках предлагалось выполнение высоких ампутаций и при такой клинической ситуации использование аллографтов стало операцией "отчаяния", направленной на "прямую" реваскуляризацию и сохранение конечности.
У пациентов с атеросклерозом наблюдали более выраженные изменения параметров допплерографии на проксимальных сегментах артерий, а у больных с комбинированным поражением, наоборот наибольшие изменения зарегистрированы в дистальных отделах ар-териального русла нижних конечностей (P<0,001). В дистальных отделах сосудистого русла (по передней и задней большеберцовым артериям) в обеих группах больных превалировал коллатеральный тип кровотока (66%), а у 25% пациентов он отсутствовал.
Артериальные аллографты хорошо моделируются благодаря наличию естественной анатомической архитектоники. При выполнении анастомозов любой локализации, в частности ниже щели коленного сустава, трансплантаты сопоставимы не только по диаметру, но и по топографии (в случае использования естественных бифуркаций и ветвей) с шунтируемыми артериями реципиента. Данное качество аллографтов позволяет анатомично восстанавливать кровоток по всем артериям голени и/или стопы, что проблематично или невозможно выполнять, используя аутовену и, тем более, синтетический протез.
Показаниями к применению аллографтов у пациентов с Атеросклерозом послужило отсутствие или непригодность аутовены в 18,5% случаев при постановке артериальных и в 53,8% - венозных аллотрансплантатов. Повторные хирургические вмешательства, потребовавшие использования артериальных аллографтов, выполнены в 45,6% случаев, а венозных - в 38,4%. В 7,6% случаев применялись алловены, а в 29,3% случаев - аллоартерии "сложной" архитектоники как первичный пластический материал для реконструкции различных сегментов пораженного артериального русла нижних конечностей. В 6,5% наблюдений двухэтажные реконструкции осуществляли артериальными аллографтами. Необходимость применения комбинированных трансплантатов возникала при повторных вмешательствах у 68,5%, а при отсутствии аутологичного материала - у 31,5% больных.
При Комбинированном поражении в виду отсутствия аутовены первичная коррекция кровотока производилась с помощью артериальных аллографтов в 78,1%, венозных - в 82,6%, комбинированных - в 66%. Повторные вмешательства с использованием артериальных аллографтов имели место в 21,9%, венозных - в 17,4%, комбинированных трансплантатов - в 24% наблюдений. Комбинированные артериальные шунты "сложной" архитектоники применили в 24%, при двухэтажных реконструкциях - в 16% случаев.
По результатам исследования в эксперименте in vitro выявлено, что в сроки до 15 суток с момента консервации аллографты полностью сохраняют свою структуру и жизнеспособность. Начиная с 15 суток, выявлялись признаки деструкция ядер лейомиоцитов (до 30%), к 30 суткам количество разрушенных ядер достигало 50%, что являлось признаком их нежизнеспособности. К 40 суткам консервации наблюдалась гибель большинства ядер (до 80%), что свидетельствовало о нежизнеспособности ткани. Однако аллографты, хранящиеся в питательной среде без антибиотиков, имели более сохранную морфологическую структуру, причем стенки аллогенных вен в течение 40 суток были в меньшей степени подвержены деструктивным изменениям, чем стенки артерий.
Согласно данным прижизненной люминесцентной и конфокальной микроскопии артериальных аллографтов наиболее активная гибель клеток наблюдалась в течение первого месяца их хранения при + 4ОС, однако часть клеток оставалась жизнеспособной даже после 2,5 месяцев хранения. Дыхательная активность митохондрий сохранялась до 30 суток "влажного" хранения, но не детектировалась через 50 суток, что указывало на их повреждение. Мы не наблюдали повреждения матрикса и существенных изменений распределения клеток даже после 75 суток "влажного" хранения при + 4ОС.
Таким образом, оптимальными сроками использования "влажных" сосудистых аллографтов следует считать от 0 до 15 суток, при температуре хранения + 4ОС в среде ТС-199 с комплексом антибиотиков.
Сравнительные гистологические исследования тромбированных сосудистых эксплантатов при повторных вмешательствах у больных обеих групп позволяют утверждать, что наблюдаемые изменения имеют ряд особенностей.
Ведущим морфогистологическим признаком нарушения функции и тромбоза аутовенозных шунтов (исследовано 13 образцов) является прогрессирование атеросклероза с формированием бляшек, как в зоне анастомоза, так и в стенке аутовены.
В синтетических протезах (12 образцов) всегда формирование рестенозов (тромбозов) в области анастомозов и по ходу протеза происходило на фоне разрастания неоинтимы. Закономерным можно считать, что перифокальные воспалительные изменения с исходом в фиброз вокруг аллографта (18 образцов) являются причиной дегенеративных изменений стенки трансплантата с последующими внутрипросветными осложнениями (кальциноз, стенозирование, тромбоз). Ту же картину наблюдали в алловенах (12 образцов), и в комбинированных шунтах (6 образцов).
Необходимо подчеркнуть, что тромбозы трансплантатов у больных с комбинированным поражением сосудов начинают развиваться в более ранние сроки, чем у больных атеросклерозом, что связано с более быстрым прогрессированием атеросклероза на фоне диабета и это не зависит от используемого пластического материала.
Аллографты не вызывали местных или общих аллергических реакций, каких либо специфических лабораторных изменений, а наличие системной воспалительной реакции, как правило, было обуссловлено наличием критической ишемии и выраженных трофических расстройств.
Нарушения гемостаза до операции проявлялись, гиперкоагуляцией (гиперфибриногенемия, увеличение САТ, удлинение времени XIIа-ЗЛ и ТВ) и угнетением фибринолиза (увеличение АПТВ). Сложность интерпретации коагулограмм после операции связана с проведением гепаринотерапии в интра - и послеоперационном периодах.
Тем не менее, через 5-7 дней после операций с использованием различных пластических материалов у пациентов обеих групп изменения гемостаза сохранялись, а по большинству параметров усугублялись, что свидетельствует о прогрессировании дисбаланса регуляторно-адаптационных систем организма, на фоне реперфузии, особенно при критической ишемии конечностей.
И здесь мы наблюдали более выраженные и частые изменения (АКТ, ТВ, АПТВ, ХIIа-ЗЛ, увеличения концентрации фибриногена), у больных с комбинированным поражениями сосудов по сравнению с больными атеросклерозом. Кроме этого, замечена разнонаправленностью сдвигов САТ и ПТВ у больных этих групп, что выражается достоверным снижением ПТВ у больных II группы, повышением САТ по сравнению с I группой. Отчетливой зависимости нарушений гемостаза от использованного материала не выявлено.
Для оценки иммунного ответа в зависимости от патологии и от используемого пластического материала в двух группах больных (40 - с атеросклерозом и 39 - с комбинированным поражением выделено по 4 подгруппы: в первой - 10 и 9 больных с аутовеной, во второй - 14 и 12 с аллографтами, в третьей - по 8 с комбинированными трансплантатами и четвертой - 8 и 10 с синтетическими протезами, соответственно.
Исходно у пациентов с атеросклерозом (I группа) наблюдался дисбаланс процессов иммунорегуляции, что проявлялось относительным лимфоцитозом и снижением иммунорегуляторного индекса за счет пониженного количества Т-хелперов. Наиболее вероятной причиной этого явилась критическая хроническая артериальная недостаточность нижних конечностей с трофическими расстройствами. В ранний (через 2 недели) и среднесрочный (через 2 месяца) послеоперационный период сдвиги клеточного и гуморального иммунитета оставались на том же уровне и не были связаны с используемым пластическим материалом.
У пациентов II группы исходно были более тяжелые воспалительные изменения со стороны периферической крови (нейтрофильный лейкоцитоз, повышение абсолютного числа лимфоцитов), что обусловлено выраженностью гнойно-некротических изменений в тканях, особенно при синдроме диабетической стопы.
Кроме того, наблюдали снижение иммунорегуляторного индекса за счет уменьшения количества Т-хелперов. Низкая исходная активность фагоцитоза при всех вариантах шунтирования проявлялась снижением фагоцитарного индекса и фагоцитарного числа.
Через 2 недели после операции с адекватно восстановленным кровотоком во всех подгруппах наблюдали слабую тенденцию к нормализации исследуемых показателей.
Однако, спустя 2 месяца угнетение процессов иммунорегуляции и фагоцитоза становились более выраженными во всех подгруппах. Выраженных нарушений со стороны гуморального звена иммунитета не наблюдали, за исключением незначительного нарастания титра Ig М через 2 месяца после операции с применением аллографтов и превышения нормального содержания Ig G.
Таким образом, иммунологические исследования выявили неко-торые изменения исходного иммунного статуса у пациентов с хронической артериальной недостаточностью нижних конечностей при атеросклеротическом и комбинированном поражении, но достоверной зависимости от вида примененного пластического материала не установлено.
Реконструктивные операции на артериях конечностей у больных обеих групп с использованием разных трансплантатов позволили восстановить кровоток у большинства пациентов.
При использовании артериальных, венозных аллографтов и комбинированных шунтов, эффективная реваскуляризация достигнута соответственно в 92-92-90% у больных I группы и 91-78-97% - II группы. При применении аутовен и синтетических сосудистых протезов - в 88 и 100% I группа, в 84 и 95% II группа, соответственно.
Проведен анализ тяжести хронической артериальной недостаточности у пациентов I и II группы до и после реконструктивных операций с использованием разных трансплантатов. Критическая ишемия конечностей наблюдалась у 177 из 369 (48,0%) пациентов I группы и 116 из 144 (80,5%) больных II группы, из них у 156 (88,1%) и у 110 (94,8%) - хроническая ишемия, у 21 (11,9%) и у 6 (5,2%) острая, соответственно.
А |
Б |
В |
Г |
|
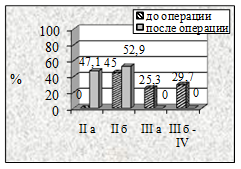
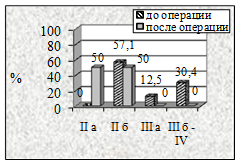
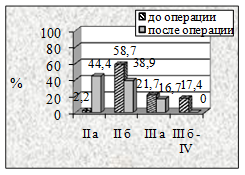
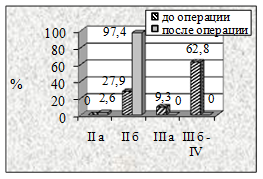
Рисунок 3. Динамика степени ХАН нижних конечностей в результате реваскуляризации у пациентов I группы в зависимости от примененных видов пластических материалов: а-артериальный аллографт, б-венозный аллографт, в-аутовена и г-синтетический протез. |
Наиболее выраженная положительная динамика степени ХАН выявлена у больных I группы (рис. 3) не зависимо от использованного пластического материала.
Через 3 месяца у 5,7% пациентов с артериальными аллографтами, у 6,12% с комбинированными трансплантатами и у 11,8% с аутовенозными шунтами на фоне восстановленного кровотока сохранялись трофические изменения в дистальных отделах конечности, а 16,7% больных с синтетическими протезами сохранялась ХАН III А степени.
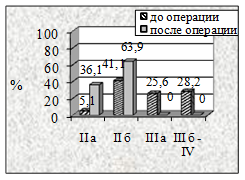
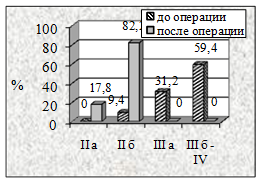
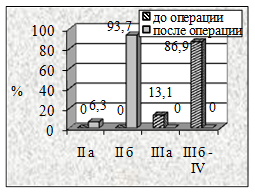
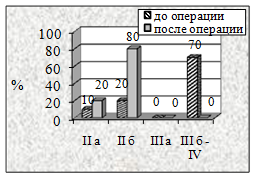
Анализ динамики степени ХАН (рис. 4) у больных II группы через три месяца показал, что из 82,1% со II Б у 28, 6% пациентов (с артериальными аллографтами), у 37,5% из 93,7% (с венозными аллографтами), у 27,3% из 81,7% (с комбинированными трансплантатами), у 22,6% из 97,4% (аутовена) и у 30% из 80% (синтетические протезы) на фоне восстановленного кровотока сохранялись трофические нарушения в виде гранулирующих язв.
У всех пациентов II группы при использовании различных видов трансплантатов критические проявления ХАН уменьшились до II Б а, в ряде случаев, до II А степени (P<0,001).
А |
Б |
В |
Г |
|
Рисунок 4. Динамика степени ХАН нижних конечностей в результате реваскуляризации у пациентов II группы в зависимости от примененных видов пластических материалов: а-артериальный аллографт, б-венозный аллографт, в-аутовена и г-синтетический протез |
Данные сравнительного анализа показателей допплерографии до и после (через 5-7 дней) реконструктивных операций с использованием разных видов трансплантатов подтверждают клиническое улучшение артериального кровотока в нижних конечностях у пациентов обеих групп.
Принципиальных различий между группами и подгруппами не выявлено, все зависело и это естественно, от полноты реваскуляризации конечностей.
Ранние послеоперационные осложнения у пациентов I и II групп при применении разных видов пластического материала наблюдались в 12,4% и 13,3% случаев, соответственно.
Несколько чаще эти осложнения имели место у пациентов обеих групп после использования артериальных, венозных аллографтов и комбинированных трансплантатов, по сравнению с применением аутовены и синтетических протезов (P>0,1-0,05).
Тромбоз трансплантата наиболее частое осложнение, которое встречалось 8,9% и 11,2%, соответственно в I и II группах. Кровотечение из мест реконструкции наблюдалось 2,9% и 2,1%.
Ранний тромбоз чаще развивался у пациентов в обеих группах после алловенозного шунтирования, чем при использовании аллоартерий (P<0,05), но недостоверно чаще при применении других артериозаменителей (P>0,1-0,25).
Причинами тромбозов в раннем послеоперационном периоде служили тактические ошибки: недооценка состояния периферического русла, технические погрешности в виде излишнего натяжения трансплантата и не полного разрушения клапана алловены.
В большинстве случаев при развитии ранних тромбозов сразу выполнялась тромбэктомия и/или повторная реконструкция с восстановлением кровотока.
При подтверждении отсутствии адекватного воспринимающего русла повторные вмешательства не выполнялись.
При возникновении тромбозов уровень поражения артериального русла и зона дистального анастомоза при повторной реконструкции, смещались на сегмент ниже.
Эта гемодинамически неблагоприятная ситуация, на фоне скомпрометированного "оттока" на голени, при повторных вмешательствах являлась показанием к использованию артериальных аллографтов "сложной" архитектоники, в том числе и при осложнениях после использования других артериозаменителей (синтетические протезы, аутовена).
Определяется тенденция к более частой ампутации нижней конечности у больных II группы при прогрессировании трофических расстройств и неадекватном восстановлении артериального кровотока, чем у больных I группы: в 1,1% и 4,1% случаев на уровне бедра с аллографтами и комбинированными трансплантатами; в 3,2% и
3,8% на уровне голени у пациентов после аллоартериального и алловенозного шунтирования; в 1,3% и 5,1% на уровне стопы при использовании комбинированных трансплантатов, аутовены и синтетических протезов (P>0,1-0,25).
Осложнения, не связанные напрямую с оперативным вмешательством (инфаркт, инсульт, сердечно-легочная недостаточность, кровотечение их ЖКТ и т. д.) произошли в 1,7 и 4,5% случаев у больных I и II групп, соответственно (P>0,1).
Отдаленные результаты реконструктивных операций прослежены в интервале от 1 года до 7,5 лет у 286 пациентов атеросклерозом (I группа), из них у 167 после реконструкции с артериальными (84) и венозными (37) аллографтами, комбинированными (46) трансплантатами и у 149 больных после применения аутовен (104) и синтетических протезов (45).
У пациентов с комбинированным поражением (II группа) - 110 человек, из них у 62 использовались артериальные (26) и венозные (15) аллографты, комбинированные (21) трансплантаты и у 48 больных применялись аутовена (40) и синтетические (8) протезы.
Отдаленная проходимость исследуемых артериозаменителей после реконструктивных операций у больных I и II групп оценена в течении 36 месяцев построением графиков распределения признаков генеральной совокупности (рис. 8 и 9).
Через 8 месяцев проходимость сосудистых трансплантатов сохранялась у 91-95% больных I группы и у 86-100% пациентов II группы.
Достоверно более низкий процент проходимости наблюдали у больных II группы с синтетическими протезами по сравнению с алло - и аутовенами (Ч2=13,3; p<0,001) и недостоверно ниже при использовании других трансплантатов у больных обеих групп (P>0,1-0,5).
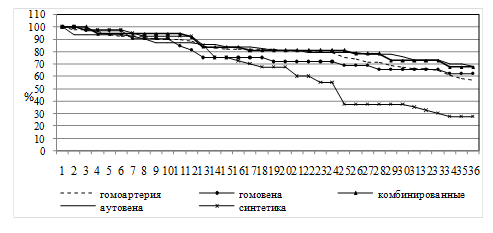
Рисунок 8. Распределение признаков генеральной совокупности проходимости исследованных артериозаменителей после реконструктивных операций на сосудах нижних конечностей у больных атеросклерозом (I группа). |

Рисунок 9. Распределение признаков генеральной совокупности проходимости исследованных артериозаменителей после реконструктивных операций на сосудах нижних конечностей у больных с комбинированным поражением (II группа). |
Через 16 месяцев достоверно более низкий процент проходимости выявлен при использовании синтетических протезов по сравнению с другими видами артериозаменителей у больных обеих групп, кроме алловен у больных I группы (P>0,1).
Необходимо подчеркнуть, что у больных II группы этот показатель был достоверно ниже, чем у пациентов I группы (Ч2=11,3; p<0,001).
Через 24, 32 и 36 месяцев у больных обеих групп процент проходимости синтетических протезов был существенно более низким, чем у больных с другими артериозаменителями (P<0,001).
У пациентов I группы разница проходимости других видов шунтов на всех этапах наблюдения была недостоверной (P>0,1-0,5). Однако у больных I группы процент проходимости всех видов артериозаменителей уменьшился на 1/3 через 32 и 36 месяцев.
Аналогичная динамика нарушений проходимости разных видов трансплантатов на всех этапах наблюдения имела место и у больных II группы. Исключение составляли больные с аутовенами, у 84% которых сохранялась проходимость через 32 и 36 месяцев.
Летальность в отдаленные сроки после использования аллографтов и комбинированных трансплантатов у больных I группы составила 3,3%, у больных II группы - 9,6% по причинам, связанным с прогрессированием основного заболевания и его осложнениями.
В отдаленном послеоперационном периоде исследовались показатели изменения качества жизни на основании данных опросника SF-36 у пациентов с атеросклерозом и комбинированным поражением, перенесших реконструктивные операций с разными видами артериозаменителей.
У больных обеих групп по данным SF-36 до оперативного лечения отмечались низкие значения оценки физического, ролевого функционирования, жизненной активности, психического здоровья и, напротив, высокие значения оценки интенсивности болевых ощущений и общего состояния здоровья, что свидетельствовало о значительном снижении качества жизни.
Через год после реконструктивных операций у больных обеих групп, которым использовались различные артериозаменители, наблюдалась существенная положительная динамика всех показателей качества жизни (P<0,05).
Все параметры оценки качества жизни в I и II группах с использованием артериальных и венозных аллографтов достоверно улучшились по сравнению аналогичными показателями при использовании других артериозаменителей, за исключением значений SF(социальное функционирование в зависимости от состояния здоровья) и GH (оценки общего состояния здоровья) у пациентов I группы (P<0,05).
Улучшение качества жизни больных подтверждено существенным улучшением кровоснабжения нижних конечностей на основании данных клинического и допплерографического исследований.
Похожие статьи
-
ВЫВОДЫ - Аллотрансплантаты в реконструктивной хирургии сосудов
1. Аллографты "влажного" хранения сохраняют свою структуру и жизнеспособность до 15 суток. Тканевой матрикс не нарушается в течение 75 суток, что...
-
Клинический материал и методы исследования - Аллотрансплантаты в реконструктивной хирургии сосудов
Работа выполнена на базе отделения сердечно-сосудистой хирургии и центра "Диабетической стопы и нарушения кровообращения в конечностях" ГУЗ Пермской...
-
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ - Аллотрансплантаты в реконструктивной хирургии сосудов
Актуальность проблемы. Одной из основных проблем реконструктивной сосудистой хирургии остается проблема выбора сосудистого трансплантата отвечающего...
-
Методы исследования - Аллотрансплантаты в реконструктивной хирургии сосудов
Диагностика нарушений кровообращения нижних конечностей осуществлялась путем сбора анамнеза, объективных данных, стандартного рутинного обследования. При...
-
Имплантат титан никелид 1. В эксперименте на 41 морских свинках (4 группы по 10 животных и 1 - интактное) изучено коррозионное воздействие среды...
-
Экспериментальные исследования - Аллотрансплантаты в реконструктивной хирургии сосудов
Методы подготовки "влажных" аллотрансплантатов. В работе использовались артериальные и венозные аллографты с консервацией и антибактериальной обработкой...
-
Озонотерапия стенокардия напряжение Одним из важных достижений медицины второй половины XX века явилось открытие факторов риска (ФР), влияющих на...
-
Сочетание туберкулеза легких и хронического вирусного гепатита В и/или С является актуальной проблемой медицины из-за частой встречаемости, отсутствия...
-
Диссертационная работа выполнена в Государственном образовательном учреждении высшего профессионального образования Пермская государственная медицинская...
-
Достоверность результатов исследований - Оценка методологического качества клинических исследований
Всякие исследования, исходя из надежности и достоверности полученных результатов и их применимости в клинической практике, характеризуются с двух позиций...
-
На предлагаемый вопрос о желании обратиться к психотерапевту 60 % основной группы дали отрицательный ответ. 40 % обследуемых желают обратиться к...
-
Понятие "стресс-теста" в кардиологии включает в себя оценку функционального резерва и состояния сердечно-сосудистой системы при выполнении различных...
-
Характеристика пациентов, включенных в исследование, понятие показателя "плотности доз". Всего обследовано 566 больных, находившихся с различными формами...
-
Серологические Не проводились Аллергические Не проводились Другие исследования Не проводились РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ Исследование крови...
-
1. ЭхоКГ 23.06.2015 Атеросклероз основания аорты. Дилатация полости левого предсердия. Кальциноз створок митрального и аортального клапана. Гипертрофия...
-
Не существует таких явлений природы, технических или социальных процессов, которые были бы предметом изучения математики, но при этом не относились бы к...
-
Предварительный диагноз., Результаты дополнительного исследования больного - Ревматоидный артрит
На основании жалоб: Больной предъявляет жалобы на постоянные боли в симметрично расположенных суставах, чувство скованности по утрам до 11 часов. 1....
-
На основании жалоб (резкие, интенсивные, схваткообразные боли в эпигастральной области, тошнота, многократная рвота с примесью алой крови и "кофейной...
-
При гистологическом исследовании тимуса мышей BALВ/c, содержавшихся при свободном доступе к пище и воде (1-я группа - пассивный контроль), установлено,...
-
Влияние засухи и бактерий Bacillus subtilis на морфометрические показатели растений В проведенных исследований были получены следующие результаты. Длина...
-
В последнее время характерно повышение внимания к изучению нервно-психических заболеваний, методов их лечения, что обусловлено их ростом во всем мире....
-
Левая и правая почки в горизонтальном и вертикальном положениях не пальпируются. Симптом Пастернацкого отрицательный с обеих сторон. Мочевой пузырь...
-
Комбинированное использование лечебно-диагностических систем в эндоскопической хирургии
В настоящем литературном обзоре обсуждается ряд вопросов, посвященных использованию криохирургического способа в экспериментальной и клинической...
-
Возраст: 77 лет. Адрес: г. Москва. Место работы: пенсионерка. Дата поступления: 21.10.01г. Дата курации: 25.10.01г. Жалобы при поступлении. Жалобы на...
-
Органы зрения: Веки безболезненны, выпячивание глазного яблока не наблюдается. Изменений в роговице нет. Роговица умеренно увлажнена, блестящая. Реакция...
-
Исследования полостных или трубчатых органов, заключающиеся в непосредственном осмотре их внутренней поверхности с помощью особых приборов - Эндоскопов...
-
Основаны на регистрации электропотенциалов или звуковых явлений, возникающих в работающем органе. Электрокардиография (ЭКГ) - Метод, основанный на...
-
Систематические и случайные ошибки - Оценка методологического качества клинических исследований
Систематическая ошибка -- это систематическое (неслучайное, однонаправленное) отклонение результатов исследований от истинных значений. Выделяют...
-
Законы наследственности, Достижения современной цитологии - Цитологические исследования
Второй этап в развитии цитологии как науки охватывает 1900-1935. Он наступил после того, как в 1900 были вторично открыты основные законы...
-
Результаты исследования - Роль медсестры в работе с людьми пожилого и старческого возраста
Исследование уровня субъективного ощущения одиночества (по методике Д. Рассела и М. Фергюсона) показало следующие результаты: Рис. 1. Уровень...
-
Результаты полученных лабораторных исследований - Сальмонеллез. Гастроинтестинальная форма
Специфические Методы 1) бактериологическое исследование (обнаружение Salmonella) Бактериологический Анализ (1.12.09) Краткое заключение: выделена...
-
Заключение. - Хронический мембрано-пролиферативный гломерулонефрит, смешанная форма, фаза обострения
Деформация ЧЛС в обеих почках, признаки отека паренхимы почек. Обзорная R-грамма органов грудной полости. Легочные поля нормальной прозрачности. Синусы...
-
ДИАГНОЗ, Результаты обследования. - Исследование жалоб на затруднение речи пациента
На основании жалоб, данных анамнеза и осмотра у больной можно подозревать наличие ишемического инсульта в бассейне левой средней мозговой артерии на фоне...
-
Результаты исследования, Видовой состав ихтиофауны - Фауна рыб нижнего течения реки Гайва
Видовой состав ихтиофауны Практически весь летний период 2015 г. являлся не типичным для Прикамья в плане погодных условий. Постоянные дожди со второй...
-
Осмотр сосудов Видимой пульсации артерий нет, симптом Мюссе отрицательный, артерии плотные Пальпация Пульс на левой руке совпадает с пульсом на правой...
-
(с указанием их симптомов) Бронхообструктивный синдром : удушье, ослабленное везикулярное дыхание, хрипы. Повышенная воздушность легкого : эмфизематозная...
-
Общий осмотр - Основные методы обследования больного при различных заболеваниях
Общий Осмотр (inspectio) больного как диагностический метод сохранил свое значение для врача любой специальности, несмотря на все увеличивающееся...
-
Синдром грушевидной мышцы - Заболевания периферической нервной системы
Грушевидные мышцы начинается у переднего края верхних отделов крестца и прикрепляется к внутреннему краю большого вертела бедра, которое она, сокращаясь,...
-
Анализ крови 27.04.06 Эритроциты - 4,46 * 10№Іл Лейкоциты - 9,6 * 109Л Hb - 148 г/л СОЭ - 10 мм/ч Базофилы Эозинофилы Юные Палочкоядерные 2...
-
Проверка гипотезы - Оценка методологического качества клинических исследований
Использование статистических методов тесно связано с представлениями о процессе познания. При столкновении с неизвестными явлениями ученые сначала...
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ - Аллотрансплантаты в реконструктивной хирургии сосудов