Лиганды каннабиноидных рецепторов - Антигипоксическое и нейропротекторное действие N-арахидоноилдофамина при моделировании острой гипоксии in vivo и in vintro
N-арахидоноилдофамин
Все агонисты CBR принято подразделять на растительные (фитоканнабиноиды), эндогенные и синтетические. Среди фитоканнабиноидов (рис. 1), в состав которых входит более 60 соединений, полученных из растения C. sativa, Впервые выделенным и наиболее хорошо изученным является Д9-тетрагидроканнабинол (ТГК), который отвечает за психоактивные эффекты экстрактов конопли и является агонистом обоих типов CBR. Другой фитоканнабиноид, каннабидиол, не является лигандом CBR, однако он оказывает значительное каннабимиметическое действие, проявляя антиоксидантные свойства, ингибируя деградацию анандамида и, возможно, взаимодействуя с другими, пока не изученными, CBR.
Наиболее известными эндогенными лигандами CBR (рис. 2) в настоящее время являются анандамид (АNА) и 2-арахидоноилглицерин (2- AG). Среди других ЭК выделяют ноладиновый эфир (2- арахидоноилглицерил эфир), виродамин и N-арахидоноилдофамин (N-ADA), однако их биологическая роль и биохимические характеристики в значительной степени остаются неизученными (Pertwee, 2006).
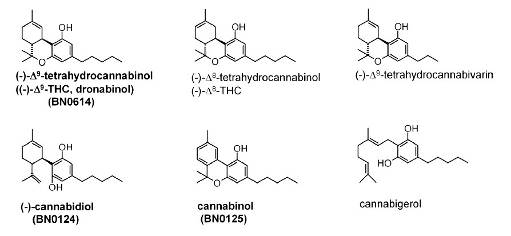
Рисунок 1 Химическая структура фитоканнабиноидов (Szabo, 2008)
Наиболее известными эндогенными лигандами CBR (рис. 2) в настоящее время являются анандамид (АNА) и 2-арахидоноилглицерин (2- AG). Среди других ЭК выделяют ноладиновый эфир (2- арахидоноилглицерил эфир,), виродамин и N-арахидоноилдофамин (N-ADA), однако их биологическая роль и биохимические характеристики в значительной степени остаются неизученными (Pertwee, 2006). Различные канабиноиды проявляют различную аффинность к разным типам CBR: некоторые являются агонистами преимущественно CBR-1 (N-ADA, АNА, ноладиновый эфир), другие представляют собой неселективные агонисты обоих типов CBR (2-AG, виродамин и др.) (Bisogno et al., 2000; Howlett et al., 2004; Massi et al, 2008; Szabo, 2008).
Синтетические лиганды CBR характеризуются большим разнообразием химического состава. Обычно их подразделяют на следующие категории: классические каннабиноиды, сохраняющие трициклическую дитерпеновую структуру ТГК (HU-210, HU-234, каннабидиол и т. д.), неклассические каннабиноиды (CP55940, CP47497, CP55244), аминоалкилиндолы (WIN 55.212- 2 и селективные агонисты CBR-1) и эйкозаноиды, которые метаболически более устойчивы и обладают большей селективностью, чемклассические каннабиноиды (O-1861, O-585, и O-689) (Szabo, 2008; Palazuelos et al., 2006).
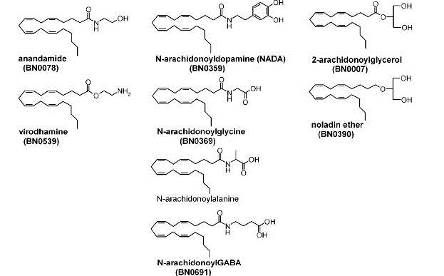
Рисунок 2 Химическая структура эндогенных лигандов каннабиноидных рецепторов (Szabo, 2008)
N-ADA относится к группе N-ацилдофаминов (амидов длинноцепочечных жирных кислот) и представляет собой амид арахидоновой кислоты с дофамином (Bobrov et al., 2008). Изначально N-ADA был синтезирован для изучения эндованилоидной системы из-за его сходства с капсаицином (агонистом TRPV1), в котором молекула дофамина также сопряжена с арахидоновой кислотой. Затем его определили, как эндогенное соединение, которое синтезируется в основном в стриатуме, черной субстанции, гиппокампе, мозжечке и является агонистом СВR (Huang et al., 2002). Было показано, что он в 40 раз селективнее связывается с CBR-1, чем с CBR-2, и практически не связывается с дофаминовыми рецепторами (Bisogno et al., 2000). Поскольку N-ADA также активирует и TRPV1 (Caterina, Julius, 2001; van der Stelt, Di Marco, 2004; Bradshow, Walker, 2005), его характеризуют как CBR-1/TRPV1 гибридный лиганд. Было показано, что связывание N-ADA с TRPV1 и CBR-1 приводит к деполяризации мембраны и повышению концентрации внутриклеточного кальция ([Ca2+]i) в дорсальных ганглиях (Huang et al., 2002; Sagar et al., 2004). Однако рядом других исследователей кальциевый ответ на действие N-ADA или капсаицина в культурах нейронов гиппокампа не обнаружен (Crawford et al., 2009). Показано, что в гиппокампе N-ADA усиливает тормозные процессы за счет стимуляции ГАМК-ергической передачи (Huang et al., 2002).
N-ADA при связывании с CBR-1 в присутствии антагониста TRPV1, IRTX, в концентрации 10 мкМ тормозит выброс глутамата из пресинаптических терминалей дофаминергических нейронов черной субстанции, и, напротив, усиливает выброс глутамата при связывании с TRPV1 в присутствии антагониста CBR-1 АМ 281 (Marinelli et al., 2007). Авторами было показано, что для эффективного связывания с TRPV1 необходимо участие мембранного транспортера эндоканнабиноидов (EMT), что объясняется расположением связывающего сайта. Следует отметить, что в отсутствие антагонистов CBR-1 или TRPV1, высвобождение глутамата нейронами черной субстанции существенно не изменялось, что, очевидно, связано с одновременной стимуляцией рецепторов обоих типов.
Кроме регуляции синаптической передачи, N-ADA индуцирует термальную гипералгезию, стимулирует спонтанную и термически вызванную активность в спинальных ноцицептивных нейронах и оказывает действие на сократительную активность гладких мышц за счет активации TRPV1, а также проявляет сосудорасширяющее действие, активируя как CBR-1, так и TRPV1 мелких сосудов брыжейки (Price et al, 2004; O'Sullivan et al, 2004; Huang and Walker, 2006).
При парентеральном введении животным N-ADA в концентрациях 1-10 мг/кг вызывает классическую каннабиноидную тетраду (гипотермия, анальгезия, снижение локомоторной активности и каталепсия), действуя, так же, как и классический агонист CBR-1. Этот эффект блокируется антагонистом CBR-1, но не блокируется антагонистами дофаминовых рецепторов (Bisogno et al., 2000).
Таким образом, N-ADA может действовать как про-, так и эндоканнабиноид, в зависимости от того, взаимодействует ли он с TRPV1 или CBR-1, соответственно.
Похожие статьи
-
ПАТОГЕНЕЗ - Острый панкреатит, отечная форма
Основной теорией патогенеза острого панкреатита является ферментативная. Основным доказательством этой теории является экспериментальное получение...
-
Фагоциты как центральное звено неспецифической защиты организма На современном этапе развития медицинской науки иммунофагоцитарная система...
-
Органы-мишени и механизм действия инсулина - Биохимия поджелудочной железы
1. В крови инсулин может быть в двух формах: свободной и связной. Органы - мишени свободного инсулина: печень, скелетная мускулатура, кишечник; связного...
-
Одним из представителей РОФ третьего эшелона является Цп - исключительно активный гликопротеин 2 - глобулиновой фракции сыворотки крови человека и высших...
-
РОФ - функционально разнородная группа белков, способных быстро изменять свою концентрацию при различных нарушениях гомеостаза независимо от природы и...
-
В гипоталамо-аденогипофизарном комплексе вырабатывается 2 типа гормонов: - рилизинг-факторы или гипофизотропные гормоны (секретируются ядрами...
-
Цитологические данные, полученные при изучении вирусных инфекций - Строгие постулаты Коха
В течение долгого времени считали, что репликация ВТМ происходит только в цитоплазме. Однако некоторые данные, полученные при цитологических и...
-
ФИЗИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ ГРЯЗИ - Лечение на курортах
Лечебные грязи влияют на организм, оказывая температурное, механическое и химическое раздражение. Физические свойства грязи позволяют пользоваться при...
-
Антибиотики - вещества, избирательно угнетающие жизнедеятельность микроорганизмов, т. е. АБ активны только против микробов при сохранении...
-
Спектры фотобилогического действия - Фотохимические превращения ДНК. Люминесцентные метки и зонды
Изучение характера действия и силы действия светового излучения, относящегося к определенному световому диапазону, обычно начинают с определения спектра...
-
Механизм действия гормонов. Роль циклазной системы в механизме действия гормонов - Понятие гормонов
По механизму действия гормоны делят на два основные типа. Первый - это белковые и пептидные гормоны, катехоламины и гормоноиды. Их молекула, подойдя к...
-
Крапивница и отек Квинке, Побочные действия местных анестетиков - Лекарственная аллергия
А. В патогенезе крапивницы и отека Квинке, вызванных Аспирином , могут участвовать разные механизмы. Б. Аспирин и другие НПВС вызывают обострение и...
-
На плотных питательных средах микробы растут в виде колоний. Колонии разных микробов отличаются по форме, размерам, консистенции, цвету и другим...
-
Реализация функциональной активности фагоцитирующих клеток находится, в том числе, под контролем различных отделов нервной системы и регуляторных...
-
Начало разработки современной концепции рецепторов и их значения в регуляции функциональной активности клеток и нервных окончаний связано с именем JN...
-
СОСАЛЬЩИК ЛЕГОЧНЫЙ - Paragonimus westermani, P. ringeri - возбудители парагонимоза - антропозооноза. Географическое распространение - районы...
-
Аутоиммунные процессы, Ожирение и питание - Изменение при сахарном диабете
На возможность значения аутоиммунного процесса (Nerup J. et all, 1978) в развитии диабета указывают ряд данных: 1) присутствие в островках поджелудочной...
-
СОСАЛЬЩИК ПЕЧЕНОЧНЫЙ - Fasciola hepatica - возбудитель фасциолеза - антропозооноза, природно-очагового заболевания. Географическое распространение -...
-
6.1 манифестная форма (на ЭКГ признаки предвозбуждения желудочков в виде дельта-волны) 6.2 преходящая форма (эпизоды ЭКГ, на которых регистрируются...
-
В каждом организме (животном, растительном или микробной клетке) все время происходят сложные процессы превращения веществ. Велика роль в этих процессах...
-
Химический состав микробов. Вода составляет основную массу микробной клетки - в капсульных бактериях ее больше, в бациллах меньше. В Aerobacter aceti...
-
Поражаемая система, Механизм действия - Токсикология мышьяка
Различают следующие типы отравлений мышьяком, которые могут явиться причиной летальных исходов: Паралитический, возникающий при огромных дозах мышьяка;...
-
Правила GMP являются общим руководством, устанавливающим порядок организации производственного процесса и проведения контроля и содержащим минимальные...
-
Заболевание анамнез диагноз обследование Зызарова Ираида Анатольевна 47 лет (03.01.1966 г.) Место работы: Адрес проживания: Поступила: 27.04.2013 г....
-
Название анестезии и показания Методика выполнения Критерий самоконтроля Мандибулярная анестезия Показания: Блокада нижнеальвеолярного и язычного нерва у...
-
Этиология Возбудитель заболевания относится к дерматотропным поксвиру-сам. Поражает различные отделы кожи, в том числе лица и век. Передается...
-
Обезболивание в современной стоматологии представляет собойкомплекс психопрофилактических и медикаментозных воздействий, направленных наснижение или...
-
Классификация - Лечебные и профилактические мероприятия при гипоксии внутриутробного плода
Гипоксия классифицируется по типу, длительности и течению: 1. По типу: 1.1. Гипоксическая гипоксия, встречается при снижении насыщения кислородом...
-
Диагностика, Инструментальное обследование пациентов при ИМ - Острый инфаркт миокарда
Лабораторные методы диагностики инфаркта миокарда: Џ Анализ крови Џ Биохимический анализ крови Џ Кровь на миоглобин Резорбционно-некротический синдром -...
-
Диагностика - Лечебные и профилактические мероприятия при гипоксии внутриутробного плода
При диагностике гипоксии необходима комплексная оценка результатов различных методов исследований. Основными методами исследования гипоксии плода...
-
Лечение и профилактика - Лечебные и профилактические мероприятия при гипоксии внутриутробного плода
В настоящее время имеется комплекс мероприятий, направленных на улучшение маточного кровотока, маточно-плацентарного кровообращения и улучшение...
-
Этиология и патогенез - Лечебные и профилактические мероприятия при гипоксии внутриутробного плода
Причинами острой гипоксии являются: 1. Неадекватная перфузия крови к плоду из материнской части плаценты (например при нарушении дыхания роженицы) . 2....
-
Жалобы при поступлении, История настоящего заболевания - Острый двухсторонний гайморит
Больная предъявляет жалобы на неприятные болевые ощущения в области носа и околоносовой области, которые постепенно нарастают, менее выражены утром и...
-
Глюкагон - Биохимия поджелудочной железы
Й. Строение и биосинтез гормона 1. Немного истории: Глюкагон впервые был получен в коммерческих препаратах инсулина в 1923г., однако лишь в 1953г....
-
Введение - Анализ нервной системы человека
Нервная система человека обеспечивает приспособление организма к воздействию внешней среды и осуществление его реакций как единого целого. Раздражение,...
-
Как управлять памятью - Технологии изучения клеточных механизмов памяти
Что, если создать трансгенных мышей, у которых, как и у уже рассмотренных, промотор немедленных ранних генов находится под контролем системы tTA-tetO или...
-
Импринтинг как научение - Классические условные рефлексы
Лоренц (Lorenz, 1935 Lorenz, 1935, Der Kumpan in der Umwelt des Vogels.) считал, что импринтинг принципиально отличается от форм научения; однако в...
-
Эти некатехоламиновые препараты представляют собой еще одну группу инотропных средств, механизм действия которых связан с селективным ингибированием...
-
Физиология восприятия вкусового ощущения - Анализаторы пищи
До сих пор не ясно, что является специфическим рецептором - вкусовая луковица или вкусовая клетка. Если верна первая гипотеза, то можно предположить, что...
-
Рефлекторные синдромы - Заболевания периферической нервной системы
Патологические импульсы из рецепторов пораженных тканей позвоночно-двигательных сегментов становятся источником моторных, вазомоторных и других...
Лиганды каннабиноидных рецепторов - Антигипоксическое и нейропротекторное действие N-арахидоноилдофамина при моделировании острой гипоксии in vivo и in vintro