Определение pH рабочих растворов при помощи хингидронного электрода - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов
Методика эксперимента. Кислотность рабочих растворов определяли с помощью хингидронного электрода. Хингидронный электрод представляет гладкую платиновую проволоку или пластину в растворе, содержащем небольшое количество хингидрона, т. е эквимолярного соединения хинона C6H4O2 и гидрохинона C6H4(OH)2. Растворимость хингидрона в воде мала, поэтому для приготовления даже насыщенного раствора достаточно небольшого количества хингидрона (0,1 г на 100 см3 H2O).Устройство хингидронного электрода изображено на рис. 2.3
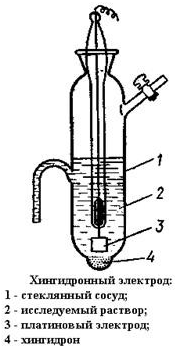
Рис. 2.3. Схема хингидронного электрода.
В водных растворах хингидрон распадается на хинон и гидрохинон, между которыми устанавливается состояние окислительно-восстановительного равновесия:
C6H4O2+2H3O++2e-=C6H4(OH)2+H2O 2.5
Eхг=Е0хг+2,3RT/2F?lg( a2Н3О+) 2.6
Из этой формулы следует, что хингидронный электрод можно использовать в качестве индикаторного на ионы водорода. При 298 К величина E0хг=0,6992 , а ее температурная зависимость имеет вид:
Е0хг=0,6992+7,4?10-4 ?(T-298) 2.7
Выражение для потенциала хингидронного электрода таково:
Eхг=0,6992+7,4?10-4 ? (Т-298) + 0,0519 +2 ? 10-4 ? (Т-298) ?lg( a H3O+ )
Предельное значение pH растворов, в которых допустимо применение хингидронного электрода, не превышает 8,5. Это обстоятельство связано с тем, что хингидрон диссоциирует в две стадии как слабая двухосновная кислота.
Для измерения pH с хингидронным электродом составляется гальваническая цепь:
- Ag, AgCl KCL KCl(нас.) H+; хингидрон PT + 2.9
Ее напряжение записывается уравнением:
E(pHX)=Eхг-ЕCl/AgCl, Ag-2,3 RT/F ? pHX (3.0)
Обработка результатов. По экспериментальным (таблице 2.3)данным, полученным для стандартных растворов, строим зависимость Е(рНо) - рНо (рис. 2.4) и по уравнению линии тренда находим рНх рабочих растворов (табл. 2.2).
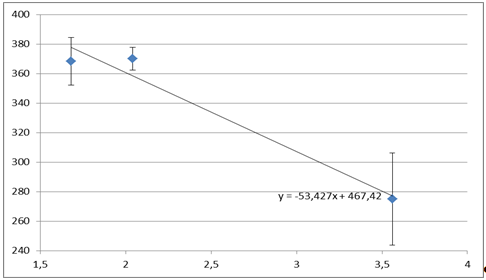
Рис. 2.4. Калибровочная зависимость Е(рНо) - рНо для хингидронного электрода.
Таблица 2.3. Данные Е(рНо) - рНо для хингидронного электрода.
|
Е1,мВ |
Е2,мВ |
Е3,мВ |
Еср, мВ |
PH |
|
380 |
375 |
350 |
368,3±30,5 |
1,68 |
|
370 |
370 |
370 |
370±14,5 |
2,04 |
|
300 |
240 |
285 |
275±59,3 |
3,56 |
Таблица 2.4. Водородный показатель рабочих растворов.
|
Растворы |
Eср, мВ |
PH |
|
0,001 M CuSO4 + 0,999 M Na2SO4 |
181,6 |
5,3 |
|
0,01 М CuSO4 + 0,99 M Na2SO4 |
198,3 |
5 |
|
0,1 М CuSO4 + 0,9 M Na2SO4 |
235 |
4,34 |
Для расчета pH используем зависимость Е(рНо) - рНо, и по уравнению линии тренда
Y= -53,427x+467,42 3.1
Определяют величину pH, как
E = - a?pH + b,
Выражают из данного уравнения x(pH).
PH = E?-b/-a 3.2
По полученному наклону калибровочной кривой можно судить о том, что электрод обратим и может использоваться в работе. По значением pH, можно сказать, что среда подкисленная, так как pH<7.По этому значению можно сделать вывод, что CuSO4 подвергается гидролизу по катиону.
Похожие статьи
-
Методика эксперимента. Простейшая электролитическая ячейка, которая может быть использована для снятия поляризационных кривых, представлена на рис. 2.5...
-
Определение удельной и молярной электропроводности сульфатных растворов Методика эксперимента. В исследованиях использовали растворы: 0,1 M CuSO4; 0,01...
-
Введение - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов
С развитием современной металлообрабатывающей промышленности и непрерывным ростом ассортимента изделий из металлов постоянно расширяется область...
-
Удельная электропроводность раствора увеличивается, а молярная - понижается с увеличением концентрации. При добавление раствору CuSO4 Na2SO4 , удельная...
-
Кинетика электродных процессов. Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале,...
-
Органические кислоты применяются при разложении минерального сырья лишь в единичных случаях, главным образом в фазовом анализе. Наиболее часто для...
-
Парентеральные вмешательства - Расчеты при приготовлении водных растворов
Введение инсулина Инсулин - гормон поджелудочной железы, назначающийся пациентам, страдающим сахарным диабетом. Один миллилитр инсулина содержит сорок...
-
Приготовление растворов - Расчеты при приготовлении водных растворов
Концентрация растворов Масса раствора состоит из массы вещества и массы воды, т. е. Концентрация раствора Для дезинфекции чаще всего используются...
-
Регрессия -- зависимость среднего значения какой-либо величины от некоторой другой величины или от нескольких величин. Задача регрессионного анализа...
-
Резерв пути показывает на сколько дней можно задержать выполнение работ, имеющих на этом пути, без ущерба для всего комплекса работ. Полный резерв...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
В разделе 1 курсовой работы требуется: Определить количество закупаемого заданным филиалом фирмы сырья у каждого АО, (xj), максимизируя прибыль филиала....
-
Иодометрический метод определения концентрацииCu2+-ионов в растворе Концентрацию в растворах определяли иодометрическим методом в коническую колбу...
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Пример 1 Далеко не во всех случаях цепь представляет собой совокупность лишь последовательно и параллельно соединенных ветвей. В качестве примера...
-
Построение корреляционных моделей исследуемых явлений
Построение корреляционных моделей исследуемых явлений Цель работы: На основе данных статистических наблюдений вывести корреляционные зависимости в виде...
-
Гомоскедастичность, Отсутствие автокорреляции остатков - Моделирование в эконометрике
Гомоскедастичность остатков означает, что дисперсия каждого отклонения одинакова для всех значений X . Если это условие не соблюдается, то имеет место...
-
Комплексообразующие свойства тиосульфатов - Тиосульфат натрия
Тиосульфат-ион - сильный комплексообразователь, использующийся в фотографии для удаления из фотопленки невосстановленного бромида серебра: Отметим, что...
-
Задание 1. - Регрессионно-корреляционный анализ предприятия
Коррекционный регрессия экономический моделирование По предложенным вам экспериментальным данным, представляющим собою макроэкономические показатели или...
-
Корреляционный анализ данных - Статистическое исследование инвестиционной деятельности в регионе
Графическое представление корреляционной зависимости. Для графического представления корреляционной связи можно использовать прямоугольную систему...
-
Заключение - Разработка методики сокращения времени выполнения проекта при помощи сетевого графика
Целью данной курсовой работы являлось сокращение времени выполнения проекта в целом. По исходным данным был представлен сетевой график. В соответствии с...
-
КРИСТАЛЛИЗАЦИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ В РАЛИЧНЫХ УСЛОВИЯХ - Химические свойства и строение воды
Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода...
-
Любая последовательность взаимосвязанных событий и работ на сетевом графике называется путем. Полный путь, это путь от исходного до завершающего события....
-
Таблица 1 - Исходные данные для расчета Работа Tminij Tнвij Tmaxij 1-2 15 17 20 1-3 25 28 30 1-4 21 23 25 2-5 14 18 20 2-6 14 17 20 2-7 8 9 10 3-7 25 28...
-
В сухую колбу Кьельдаля вносят 0,1 г исследуемого продукта, наливают 5 см3 концентрированной серной кислоты. Добавляют небольшое количество катализатора....
-
Растворимость йода в воде невелика (около 0,2 г/л или при-мерно 1 * 10"3 моль/л), поэтому его титрованные растворы гото-вят растворением точной навески...
-
Определение средних температур теплоносителей t tКонд. гр. п. ?tМ tНач ?tБ t'Нач F Рис. 1 Температурная схема Где t'Нач - начальная температура...
-
Определяли динамическую обменную емкость, полную динамическую обменную емкость и степень отмывки смолы КУ-2 от Cu2+-катионов 5% раствором серной кислоты....
-
Определение рабочей скорости газового потока - Абсорбция аммиака
Рабочую скорость газа принимают в зависимости от технических, эксплуатационных, экономических и других факторов. Обычно она превышает половину скорости...
-
ФАКТОРНАЯ МОДЕЛЬ ПРИ НОРМИРОВАННЫХ ПЕРЕМЕННЫХ - Многомерный статистический анализ
С математической точки зрения факторный анализ аналогичен множественному регрессионному анализу в том смысле, что каждая переменная выражена как линейная...
-
Построение модели с помощью логистической регрессии Прежде чем строить логистическую регрессию, необходимо выбрать конечный набор финансовых и...
-
Процессы, основанные на микробиологической ферментации, разработаны и для получения ряда других органических кислот. Среди них -- глюконовая кислота и ее...
-
В статье рассматриваются вопросы, связанные с совершенствованием процессов управления непрерывными ХТС. Предлагается возможность такой организации...
-
В основе метода площадей лежит предположение, что объект может быть описан линейным дифференциальным уравнением с постоянными коэффициентами, а его...
-
Оборудования, используемые для определения ртути Класс опасности - 1, ПДК в населенных пунктах (среднесуточная) -- 0,0003 мг/мі ПДК в жилых помещениях...
-
В данной главе описан способ прогнозирования с помощью НС, основанный на методе окон. Также приведен обзор применения НС в финансовой сфере. Общий подход...
-
Получение тиосульфата натрия при мышьяково-содовой очистке газов - Тиосульфат натрия
В процессе очистки от сероводорода коксового и других промышленный газов мышьяково-содовым методом, помимо основной реакции: Протекают побочные реакции,...
-
Определение необходимого объема выборки - Основы эконометрики
В практике проектирования выборочного наблюдения возникает вопрос о необходимой численности выборки, которая необходима для обеспечения определенной...
-
Методы очистки коллоидных растворов - Методы очистки и получения коллоидных растворов
При получении коллоидных растворов тем или иным методом, особенно с помощью химических реакций, практически невозможно точно предусмотреть необходимое...
-
Реализуем математическую модель (2) (6) в MS Excel. Для этой цели построим таблицы исходных данных задачи по расчету оптимального графика занятости при...
Определение pH рабочих растворов при помощи хингидронного электрода - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов