Молекулярные перегруппировки
Молекулярные перегруппировки
Это химические реакции, в результате которых происходит изменение взаимного расположения атомов в молекуле, места кратных связей и их кратности. Они могут осуществляться с сохранением атомного состава молекулы (изомеризация) или с его изменением. Молекулярные перегруппировки, в результате которых образуются молекулы, идентичные исходным, называются вырожденными.
Все они делятся на два основных типа:
- 1. межмолекулярные, когда мигрирующая группа атомов или атом (сокращенно - группа) полностью отделяется от молекулы и может присоединяться к какому-либо атому другой такой же молекулы; 2. внутримолекулярные, когда мигрирующая группа переходит от одного атома к другому в одной и той же молекуле.
Молекулярные перегруппировки, в ходе которых происходит внутримолекулярная миграция группы со своей парой электронов к электронодефицитному центру, называются нуклеофильными или анионотропными (1), а при миграции к углеродному атому, содержащему неподеленную пару электронов - электрофильными или катионотропными (2).
Наименование. Схема процесса. Комментарий
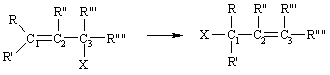
Аллильная Изомеризация ненасыщенных соединений, происходящая со сдвигом двойной связи из положения 1-2 в положение 2-3 при одновременной миграции атома (или группы атомов) от третьего углеродного атома (аллильное положение) к первому. К ней относят прототропные и анионотропные миграции. Наиболее характерна для непредельных карбонильных соединений или нитрилов, аллиловых эфиров, аллиламинов и арилированных пропиленов. Основания являются универсальными катализаторами перегруппировки. Большинство этих миграций обратимо и равновесие сдвинуто в сторону изомера, у которого у кратной связи расположено наибольшее число арильных, алкильных и других заместителей, обеспечивающих создание сопряженной связи. Эта перегруппировка происходит спонтанно и при аллильном замещении.
Альдегидо-кетонная
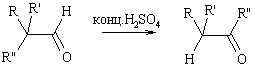
Превращение альдегидов в изомерные кетоны в присутствии кислот. В реакцию вступают альдегиды с вторичными или третичными ?-углеродным атомом. Как арильные, так и алькильные радикалы способны к миграции. У жирноароматических альдегидов мигрирует алкильный радикал.
Амадори
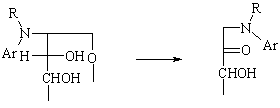
Перегруппировка N-арилгликозиламинов в 1-амино-1-дезоксикетозы в присутствии слабых кислот. В спирте происходит очень быстро. При действии аммиака или первичных аминов на кетозы наблюдается ретро-перегруппировка Амадори.
Ацетилен-алленовая
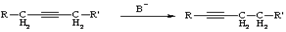
Катализруемая основаниями перегруппировка. Использование в качестве основания KNH(CH3)3NH2 приводит к практически мгновенной миграции тройной связи.
Бамбергера 2
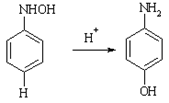
Перегруппировка арилгидроксиаминов в П-аминофенолы в присутствии минеральных кислот. Если в исходном Пара-положение занято, то образуются хинолы.
Бамбергера 1

Перегруппировка арилнитраминов в О-нитроанилины под действием кислотю
Бартона

Фотохимическая перегруппировка алкилнитритов в нитрозоспирты с последующим превращением последних в оксимы или димеры. реакция идет при охлаждении в инертном растворителе при ?>330 нм. Реакция идет по свободно-радикальному механизму
Беаль-Соммле
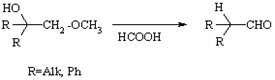
Перегруппировка оксиалкилметиловых эфиров в альдегиды в присутствии карбоновых кислот
Бейкера-Венкатарамана
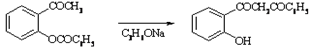
Перегруппировка 2-бензоилоксиариметилкетонов в 2-оксиароилбензоилметаны под действием оснований. Препаративное значение реакции обусловлено легкостью циклизации получаемых продуктов в хромоны.
Бекмана

Изомеризация оксимов кетонов в амиды кислот под действием водоотнимающих агентов: пятихлористый фосфор, бензолсульфохлорид, ацетихлорид, олеум, полифосфорная кислота. При обработке альдоксимов реагентами бекмановской перегруппировки получают, как правило, нитрилы и лишь редко амиды кислот. Промышленное применение для получения капролактама из оксима циклгексанона.
Бензидиновая
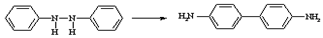
Внутримолекулярная изомеризация гидразосоедиений в 4,4'-диаминобифенилы (замещенные бензидины) под действием сильных кислот. При перегруппировке образуется также некоторое количество 4,2'-изомера. В ряду нафталина перегруппировка может происходить и в отсутствии кислот.
Бензиловая

Перегруппировка ароматических дикетонов в оксикислоты под действием щелочи: Подобное превращение претерпевают также алициклические и гетероциклические дикетоны. В алифатическом ряду перегруппировка осуществляется редко.
Бензильная
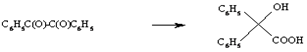
Превращение ?-дикетонов под влиянием щелочей в ?-оксикислоты. Кроме ароматических дикетонов в реакцию вступают алициклические, алифатические и гетероциклические дикетоны, а также хиноны.
Боултона-Катрицкого

Перегруппировка 5-замещенных 4-нитробензофуроксанов в 7-замещенные. Идет медленно уже при 20ОС.
Вагнера-Меервейна

Камфеновая перегруппировка 1 рода - изомеризация углеродного скелета алициклических соединений вследствие 1,2-миграции алкильной группы в промежуточном карбкатионе при нуклеофильном замещении, присоединении или элиминировании. Осуществляется под действием протонных кислот или кислот Льюиса в растворах и расплавах при нагревании или на холоду. Часто приводит к расширению или сужению циклов. Наибольшее значение имеет для бициклических терпенов, например для получении камфоры из пинена, изоборнилацетата из камфена.
Валлаха

Изомеризация азоксисоединений в П-окси - или О-оксипроизводные азобензола. Катализируемая кислотами приводит только к Пара-изомерам, а при УФ-облучении дает Орто-оксипроизводные.
Виттига
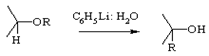
Перегруппировка простых эфиров в спирты под действием фениллития. В реакцию вступают бензиловые, бензгидриловые и другие эфиры, содержащие ароматические заместители.
Вольфа

Перегруппировка диазокетонов в кетены при нагревании в присутствии катализатора. Реакция имеет большое значение, так как неустойчивые кетены могут быть легко переведены в карбоновые кислоты и их производные. Разложение диазокетонов может быть также осуществлено в водном растворе под действием УФ-облучения - так называемая модификация Хорнера. Частным случаем перегруппировки Вольфа является реакция Зюса - фотохимическая перегруппировка О-хинондиазидов, которые легко получаются диазотированием О-аминохинонов.
Гофмана
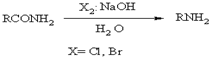
Перегруппировка амидов кислот в первичные амины под действием гипогалогенитов в водном растворе. Проведение реакции в спиртовом растворе приводит к образованию уретанов. Для увеличения выхода аминов из амидов высших карбоновых кислот реакцию проводят в спиртовом растворе, a образовавшиеся уретаны омыляют до аминов. Амиды окси и непредельных кислот превращаются в альдегиды, а амиды пропиоловых кислот - в нитрилы.
Гофмана-Лефлера-Фрайтага

Замыкание пирролидиновго кольца при нагревании N - галогенпроизводных вторичных алифатических аминов в концентрированной серной кислоте. Аналогично реагируют хлорпроизводные первичных аминов. Выходы повышаются при УФ-облучении.
Гофмана-Мациуса
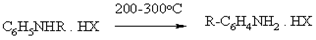
Термическая перегруппировка гидрохлоридов N-алкиланилинов в С-алкилнилины. В реакцию вступают и N, N-диаклианилины. В основном образуются Пара-изомеры.
Данилова

Изомеризация альдегидов с вторичными или третичными ?-углеродными атомами в кетоны под действием кислот. В реакцию вступают альдегиды с алифатическими и ароматическими заместителями.
Демьянова
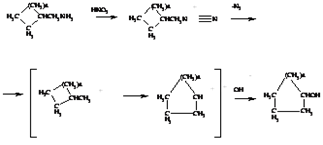
Расширение или сужение цикла на один атом углерода при превращении алициклических или гетероциклических первичных аминов в спирты под действием азотисто кислоты. Побочные реакции - образование ненасыщенных циклических соединений.
Димрота
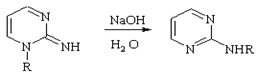
Изомеризация 1-замещенных 1,2-дигидро-2-иминопиримидинов в 2-замещенные аминопиримидины под действием оснований. В неводных средах сильно замедляется. Имеет общий характер и наблюдается для триазинов, тетразолов, тиадиазолов.
Землера-Вольфа - Шретера

Перегруппировка оксимов непредельных алициклических оксимов в ароматические амины под действием бекмановской смеси.
Имид-амидная
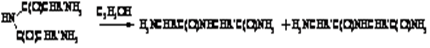
Превращение диациламидов в смесь изомерных амидов дипептидов. Реакция очень чувствительная к влиянию стерических факторов, что обуславливает в одних случаях получение смеси примерно равных количеств изомеров, в других - образование главным образом одного изомера.
Канницаро
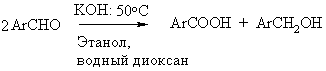
Окислительно-восстановительное диспропорционирование двух молекул ароматического альдегида в соответствующие спирт и кислоту. В реакцию вступают также гетероциклические и алифатические альдегиды, не содержащие атом водорода в ?-положении к карбонильной группе. Реакция реализуется в перекрестном варианте при использовании двух неодинаковых альдегидов. Известна внутримолекулярная реакция представляющая собой превращение ?-кетоальдегидов в ?-оксикилоты. Известен также, так называемый вариант Локка - превращение альдегидов в кислоты сплавлением со щелочами.
Кляйзена

Термическая перегруппировка аллиловых эфиров фенолов или енолов в изомерные С-аллильные производные. Если оба орто-положения в аллиловых эфирах фенолов заняты, то аллильная группа мигрирует в Пара-положение без перемещения двойной связи в аллильном остатке подобно аллиловым эфирам известна перегруппировка енаминов в имины (амино-перегруппировка Кляйзена). Аналогичной перегруппировке подвергаются непредельные тиоэфиры.
Коста

Рециклизация под действием оснований гетероциклических соединений пиридинового и пиримидинового ряда, содержащих в положении к гетероатому группировку с подвижным атомом водорода. Происходит с размыканием гетероцикла по связи C-N и с последующим замыканием цикла по связи С-С.
Коупа
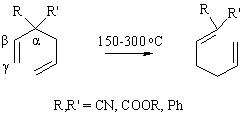
Термическая изомеризация 1,5-диенов, сопровождающаяся миграцией аллильной группы от ?- к ?-углеродному атому и сдвигом двойных связей из ?, ?- в ?,?-положение. Протекает через циклическое переходное состояние с инверсией аллильной группы. Диены не содержащие акцепторов, реагирую в более жестких условиях. Перегруппировка не происходит, если ?,?-двойная связь - часть ароматической системы. Синтез кетонов термической изомеризацией 3-окси-1,5-диенов называют окси-перегруппировкой Коупа.
Курциуса
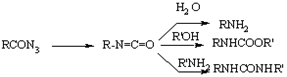
Получение первичных аминов термической перегруппировкой азидов карбоновых кислот в изоцианаты с последующим гидролизом. Применима также к гетероциклическим и алициклическим азидам, содержащим различные функциональные группы. Азиды ?-галогензамещенных и ?,?-непредельных карбоновых кислот в этих условиях дают альдегиды или кетоны. Перегруппировка катализируется сильными кислотами. Метод широко применяется для синтеза изоцианатов, уретанов и N, N'-дизамещенных мочевин.
Ландебурга
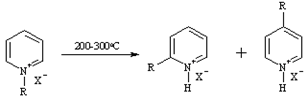
Термическая изомеризация солей N-алкил - или N-арил-пиридиния с образованием солей 2- или 4-алкил(арил)пиридиния. При температуре выше 3000C происходит расщепление цикла. Присутствие кислотных катализаторов способствует протеканию реакции в положение 2.
Лоссена
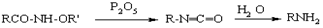
Перегруппировка гидроксамовых кислот или их производных в изоцианаты под действием дегидратирующих агентов. Механизм реакции аналогичен механизму родственных анионотропных перегруппировок Гофмана, Курциуса. Используется для синтеза уретанов и аминов из карбоновых кислот.
Мак-Фейдиена-Стивенса
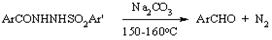
Перегруппировка арилсульфонилгидразидов в альдегиды при нагревании с безводным карбонатом натрия. Аналогично образуются гетероциклические альдегиды. Алифатические альдегиды не могут быть получены эти методом.
Мейера-Шустера

Перегруппировка третичных и вторичных ?-ацетиленовых спиртов в ?,?-непрелельные кетоны или альдегиды в присутствии кислотных катализаторов.
Мейзенгеймера
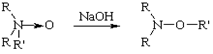
Перегруппировка N-окисей третичных аминов в О-эфиры дизамещенных гидроксиламинов при нагревании со щелочью а атмосфере азота. Перегруппировке подвергаются также N-окиси иминов.
Металлотропия
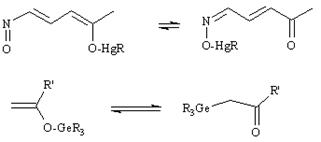
Миграция катиона металла или металлсодержащего остатка в молекуле ненасыщенного органического соединения, сопровождающаяся изменением положения кратной связи.
Небера
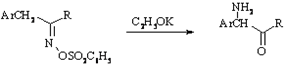
Перегруппировка сульфонатов кетоксимов в ?-аминокетоны под действием оснований. Реакцию проводят в атмосфере азота.
Ньюмена - Куорта

Термическая перегруппировка О-арилтиокарбаматов S-арилтиокарбаматы.
Ортона

Перегруппировка N-галоген-N-ацилариламино в О-П-галогенариламиды под действием кислот. Перегруппировка идет и для производных нафталина. Может протекать в неводных средах под действием ClCH3COOH, C6H5CH2COOH.
Пинаколиновая
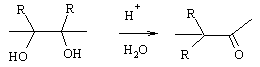
Перегруппировка углеродного скелета молекулы при дегидратации гликолей под действием кислот с образованием альдегидов или кетонов. Классическим примером пинаколиновой перегруппировки является превращение 2,3-диметил-бутандиола-2,3 в пинаколин. Пинаколиновую перегруппировку катализируют органические и минеральные кислоты, ацетилхлорид, хлорид цинка, иод в ацетоне.
Пропаргильная

Пропаргильная анионотропная перегруппировка протекает в разнообразных условиях в присутствии и различных катализаторов (хлорид меди I, хлорид аммония).
Пумерера
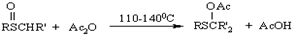
Превращение сульфоксидов, содержащих не менее одного ?-водородного атома, в ?-ацилоксисульфиды под действием ангидридов карбоновых кислот. Особенно легко вступают в реакцию ?-сульфоксиды, ?-оксо - и ?-сульфенилсульфоксиды. Аналогичная реакция происходит при действии на сульфоксиды хлорангидридов карбоновых кислот и неорганических галогенидов. В этих случаях образуются ?-галогенсульфиды.
Робева
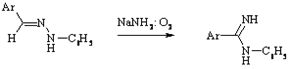
Перегруппировка фенилгидразонов ароматических альдегидов в N-фениламидины под действием амидов щелочных металлов в присутствии окислителей. В реакцию вступают фенилгидразоны гетероциклических альдегидов.
Роу
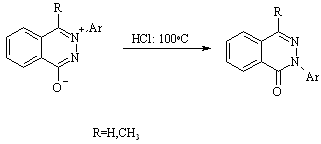
Перегруппировка 3-арилфталазонов в 2-арилфталазоны при нагревании с разбавленной кислотой.
Семигидробензоиновая
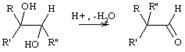
Превращение вторично-третичных гликолей в альдегиды при действии водоотнимающих средств Является первой стадией семипинаколиновой перегруппировки.
Семидиновая
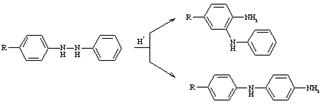
Превращение замещенных гидразобензолов в О- или П-дифениламины (семидины) под действием сильных кислот.
Семипинаколиновая
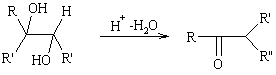
Превращение вторично-третичных гликолей в кетоны при действии водоотнимающих средств. Первой стадией этого превращения является семигидробензоиновая перегруппировка, а во второй - альдегидо-кетонная.
Смайлса
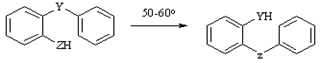
Изомеризация ароматических соединений (диариловых эфиров, диарилсульфоксидов, диарилсульфидов, карбоновых кислот ароматического ряда) под действием щелочей. Происходит в результате внутримолекулярного нуклеофильного замещения ароматических соединений (диариловых эфиров, диарилсульфидов, диарилсульфоксидов, диарилсульфонов, ариловых эфиров сульфо - и карбоновых кислот ароматического ряда) под действием щелочей.
Содди
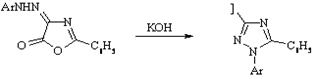
Перегруппировка 4-арилазооксизолидонов-5 в замещенные 1,2,4-триазолы под действием оснований.
Соммле
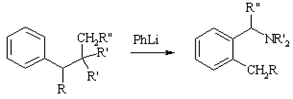
Перегруппировка под действием сильных оснований (фениллитий, амид натрия) солей триалкилбензиламмония в третичные амины, содержащие О-алкилбензильную группу. Многократное повторение перегруппировки позволяет заменить все атомы водорода бензольного кольца на алкильные группы. Аналогично реагируют соли сульфония.
Стивенса
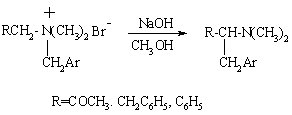
Внутримолекулярная перегруппировка четвертичных аммониевых оснований в третичные амины под действием оснований. Аналогичную перегруппировку претерпевают соли сульфония, арсония, стибония и фосфония. В качестве оснований могут служить алкоголяты натрия, амид натрия, фениллитий. В последнем случае возможна перегруппировка Соммле.
Фаворского
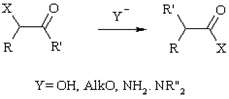
Перегруппировка ?-галогенкетонов в карбоновые кислоты или их производные под действием оснований.
Фишера-Хеппа
Перегруппировка ароматических N-нитрозаминов, в П-нитрозоанилины под действием кислот. Перегруппировки подвергаются и производные нафталина.
Фриса
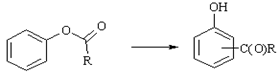
Перегруппировка сложных эфиров фенолов в О- или П-ацилфенолы в присутствии хлористого алюминия. Проведение реакции при температуре выше 100О способствует Орто-замещению, при более низких температурах в основном образуются Пара-изомеры.
Фрича-Буттенберга-Вихеля
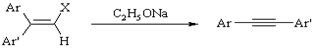
Перегруппировка диарилгалогенэтенов в диарилацетилены под действием сильных оснований.
Хаяши

Перегруппировка 3-замещенных 2-ароилбензойных кислот в 6-замещенные 2-ароилбензойные кислоты под действием концентрированной серной кислоты.
Чепмена

Термическая перегруппировка ароматических иминоэфиров в N, N'-диариламиды ароматических карбоновых кислот.
Шенберга
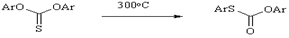
Термическая перегруппировка диарилтионкарбонатов в диарилтиолкарбонаты. Реакцию используют для получения тиофенолов и восстановления фенолов.
Штиглица
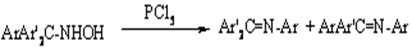
Перегруппировка триарилметилгидроксиламинов в анилы под длействием пятихлористого фосфора. Аналогично перегруппировываются хлор - и бромамины под действиемоснований, а также азиды - при нагревании в запаянной трубке.
Похожие статьи
-
Математически строго аддитивны только массы смешиваемых тел, но иногда аддитивные объемы, а также молекулярные массы. Касаемо структуры молекул, правило...
-
1. В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) - связывающую, энергия которой ниже, чем энергия...
-
Образование фенолятов, Реакции ароматического ядра фенолов - Спирты и фенолы
Образование простых эфиров фенолов алкилированием фенолятов: ArONa + RI > ArOR + NaI ArONa + (CH3O)2SO2 > ArOCH3 + CH3O-SO2ONa Образование...
-
Алюминий - самый распространенный в земной коре металл. На его долю приходится 5,5-6,6 мол. доли % или 8 масс. %. Главная масса его сосредоточена в...
-
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы - органическая...
-
ПРОХОЖДЕНИЕ ЧЕРЕЗ ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР - Процесс катализа
Закон Аррениуса - экспериментально установленный факт. Он утверждает, что скорость реакции возрастает с увеличением температуры для преобладающего...
-
Винилхлорид -- достаточно активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора. Наибольший...
-
Обзор литературы - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование - введение нитрогруппы - NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам;...
-
Кинетика процесса нитрования - Синтез пара-нитродифенила. Теоретические основы нитрования
Нитрование ароматических углеводородов смесями азотной и серной кислот протекает по ионному механизму. В. В. Марковников указал, что при взаимодействии...
-
Полиэлементоорганосилоксаны - Кремнийорганические полимеры
Введение атомов металлов в полимерную силоксановую цепь существенно меняет физические и химические свойства полимеров. Полиалюмофенилсилоксан и...
-
Свойства, характерные для альдегидов - Классификация углеводов
А) Взаимодействие с оксидом серебра (I) в аммиачном растворе (реакция "серебряного зеркала"): C6H12O6 + Аg2O > C6H12O7 +2Ag Глюкоза глюконовая...
-
В связи с тем, что для синтеза целевых фталоцианинов, аннелированные гетероциклическими хинонами мы выбрали метод темплатного синтеза, то первым шагом...
-
Фенолфталеин - один из наиболее широко используемых индикаторов, особенно при объемном определении слабых кислот. Он обладает рядом преимуществ: не...
-
Строение и свойства простагландинов - Простагландины. Строение. Биороль
ПРОСТАГЛАНДИНЫ (PG), биологически активные липиды, представляющие собой производные гипотетич. про-становой к-ты (ф-ла I) и различающиеся положением...
-
Кислородсодержащие органические соединения
К числу кислородсодержащих органических соединений, состоящих из атомов С. Н, О, относятся спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, сложные...
-
Химические свойства спиртов - Спирты и фенолы
Ряд химических свойств спиртов является общим для всех спиртов; имеются также и реакции, по-разному протекающие для первичных, вторичных и третичных...
-
ДИСПЕРСНЫЕ СИСТЕМЫ - Неограническая химия
Задание 5.1. В определенном объеме раствора V л содержится m г вещества. Плотность раствора с (табл. V.1). Рассчитайте: 5.1.1. Процентную концентрацию...
-
А) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) - элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих...
-
Генетические ряды, Номенклатура энантиомеров - Оптические изомеры и их влияние на организм человека
Вещества, различные по строению, но имеющие родственную конфигурацию у асимметрического центра, относятся к одному и тому же стереохимическому ряду(D-или...
-
Взаимодействие с галогенами - Химические свойства насыщенных углеводородов
В обычных условиях хлор и бром реагируют с насыщенными углеводородами, но лишь очень медленно. Если встряхивать жидкий предельный углеводород с бромной...
-
1. Спирты реагируют со щелочными металлами (Na, K и т. д.) с образованием алкоголятов: 2R--OH + 2Na 2R--ONa + H2 Реакция протекает не так бурно, как при...
-
Исследования, проводимые в последние годы, указывают на перспективность использования систем, для которых характерна фотоинициируемая валентная...
-
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ - Характеристика основных видов растворов
Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток можно подразделить на две группы: электролиты и...
-
Химическая связь - Квантовые концепции в химии
Химия изучает процессы превращения молекул при воздействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного...
-
ВИДНЫЕ ДЕЯТЕЛИ ХИМИИ О КАТАЛИЗЕ - Процесс катализа
И. Берцелиус (1837): "Известные вещества оказывают при соприкосновении с другими веществами такое влияние на последние, что возникает химическое...
-
ПОДГОТОВКА ОБЖИГОВОГО ГАЗА К КОНТАКТНОМУ ОКИСЛЕНИЮ. - Получение серной кислоты
Подготовка обжигового газа к контактному окислению заключается в удалении из него примесей, присутствие которых может вызвать затруднения при проведении...
-
Химические свойства Бора. - Третья группа периодической системы
Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С...
-
Химические свойства алюминия и его соединений - Алюминий и его свойства
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид). I. Взаимодействие с простыми...
-
На холоду даже дымящаяся серная кислота (олеум) почти не действует на предельные углеводороды, но при высокой температуре она может их окислять. При...
-
Общее понятие о цепных реакциях и автокатализе - Принципы горения и взрыва
К цепным реакциям относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая...
-
АНАЛИТИКА Компиляция выдержек из различных источников - удельная б-активность U235 и U238 составляет соответственно 0,08 и 0,012 Бк/мкг (или 80 и 12...
-
ДОПОЛНИТЕЛЬНЫЙ ОПЫТ. ПЕРИОДИЧЕСКАЯ РЕАКЦИЯ - Свойства галогенов
Приготовить в двух отдельных стаканчиках раствор 0,72 г иодата калия в 8 мл 2%-ной хлорной кислоты и раствор 0,3 г малоновой кислоты, 0,1 г сульфата...
-
История открытия селена - Великие открытия Йенса Якоба Берцелиуса
Селен (англ. Selenium, франц. Selenium, нем. Selren) открыт Берцелиусом в 1817 г., который так рассказывает об этом открытии: "Я исследовал в сотружестве...
-
К числу таких реакций относятся взаимодействия солей двухвалентных катионов (кроме Ca2+, Sr2+, Ba2+) с водными растворами карбонатов натрия или калия,...
-
Методы устранения жесткости - Жесткость воды и способы устранения
Чтобы избавиться от временной жесткости необходимо просто вскипятить воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с катионами и...
-
МАЗЕВЫЕ ОСНОВЫ, ЛИПОФИЛЬНЫЕ ОСНОВЫ - Производство мазей
Основа в составе мази является активным носителем лекарственного вещества, влияющим на фармакокинетическую активность, консистентные свойства мази и ее...
-
ГИДРОФИЛЬНЫЕ ОСНОВЫ, ГИДРОФИЛЬНО-ЛИПОФИЛЬНЫЕ ОСНОВЫ - Производство мазей
Основы относящиеся к этой группе, не содержат в своем составе жиров и жироподобных веществ. Они смешиваются во всех соотношениях с водой, но химически...
-
Органические кислоты в различных условиях могут разлагаться с образованием предельного углеводорода по общей схеме O R-C RH + CO2 Кислота OH Углеводород...
-
Практическое применение - Йодометрия
Йодометрия является весьма универсальным методом. Йодометрически можно определять восстановители, окислители, кис-лоты и вещества, не обладающие...
-
Или N экв.1=n экв.2 для газообразных ве-в наряду с понятием молярного V (22,4 моль/л), исп-ся понятие - молярный объем эквивалента-это V одного моль...
Молекулярные перегруппировки