МЕТОДЫ ПОДГОТОВКИ СЫРЬЯ - Свойства кобальта и его комплексных соединений
В настоящее время известно много способов по переработке и обогащения сырья.
Кобальт
1) Кобальт - относительно редкий металл, и богатые им месторождения в настоящее время практически исчерпаны. Поэтому кобальтсодержащее сырье (часто это никелевые руды, содержащие кобальт как примесь) сначала обогащают, получают из него концентрат. Далее для извлечения кобальта концентрат или обрабатывают растворами серной кислоты или аммиака, или методами пирометаллургии перерабатывают в сульфидный или металлический сплав. Этот сплав затем выщелачивают серной кислотой.
Иногда для извлечения кобальта проводят сернокислотное "кучное" выщелачивание исходной руды (измельченную руду размещают в высоких кучах на специальных бетонных площадках и сверху поливают эти кучи выщелачивающим раствором). Для очистки кобальта от сопутствующих примесей все более широко применяют экстракцию.
Наиболее сложная задача при очистке кобальта от примесей - это отделение кобальта от наиболее близкого к нему по химическим свойствам никеля. Раствор, содержащий катионы двух этих металлов, часто обрабатывают сильными окислителями - хлором или гипохлоритом натрия NaClO.
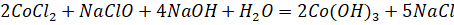
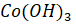
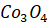
Черный осадок прокаливают для удаления воды, а полученный оксид восстанавливают водородом или углеродом. Металлический кобальт, содержащий до 2-3% примесей (никель, железо, медь), может быть очищен электролизом.
2) Изобретение относится к области цветной металлургии, в частности к технологии производства огневого кобальта в электродуговых печах постоянного тока. Способ включает плавку шихты из оксидов кобальта и углеродистого восстановителя, восстановление и обезуглероживание кобальта после полного расплавления. При этом плавку ведут при содержании углеродистого восстановителя в шихте 16-21 мас.%. Обезуглероживание проводят при силе тока в дуге, составляющей 90-95% от его максимального значения. При достижении концентрации углерода в кобальте 0,3% силу тока устанавливают максимальной и равной 6,3 кА. Техническим результатом является увеличение удельной производительности процесса и сокращение удельного расхода электроэнергии. Прототипом изобретения является способ получения кобальта восстановительной плавкой оксидов кобальта, когда операции плавки и обезуглероживания металлического кобальта осуществляют при напряжении 300 В и силе тока в дуге 5,5 кА.
При этом общая производительность процесса по металлическому кобальту составляет 0,260-0,285 т Со/ч, удельная производительность по шихте (смесь оксидов кобальта и восстановителя) 0,37-0,42 т/ч, удельный расход электроэнергии 1627-2311 кВт-ч/т. Содержание восстановителя в шихте плавки составляло 13-14% [16].
Получение хлорида кобальта:
Действием хлора на нагретый до 550--600 °C порошкообразный кобальт Растворением окислов или карбоната кобальта в НСl с последующей дегидратацией в вакууме при 150 °C или обработкой SOCl2
Получение нитрата натрия
- 1) Изобретение относится к способу получения нитрата натрия. Способ включает обработку нитрит-нитратного щелока отходящими газами аффинажного производства, содержащими оксиды азота, до стабилизации величины pH 2,0-0,5 в течение 15-20 мин. Способ получения нитрата натрия из нитрит-нитратного щелока обработкой его при температуре 80-90ОС и перемешивании раствором азотной кислоты 3NaNO2 + 2HNO3 = 3NaNO3 + H2O + 2NO
Сущность способа заключается в том, что в водной пульпе происходит инверсия нитрита натрия в нитрат натрия за счет взаимодействия с оксидами азота
NaNO2 +NO2 =NaNO3 +NO(2)
При этом щелочная среда исходного раствора, содержащего NaNO2, NaNO3, NaOH (рН 12-9), превращается в нейтральную по реакции (2) (водный раствор NaNO3) и при дальнейшем барботаже через раствор оксидов азота среда становится кислой за счет реакций
2NO2 +H2O=HNO2 +HNO3 (3)
NO2 + NO + H2O = 2HNO2 (4)
- 3HNO2 =HNO3 +2NO+H2O(5) 3NO2 +H2O=2HNO3 +NO(6)
Такое изменение кислотности реакционных растворов позволяет легко контролировать окончание процесса инверсии нитрита натрия в нитрат натрия по величине рН раствора.
Стабилизация рН в выбранном интервале (2,0-0,5) в течение 15-20 мин при 70-90ОС обеспечивает завершенность процесса превращения нитрита в нитрат натрия в оптимальных условиях.
Увеличение рН выше 2 приводит к неполноте превращения NaNO2 в NaNO3, а уменьшение рН ниже 0,5 приводит к повышенной концентрации в растворе азотной кислоты, полученной по реакциям (3), (5), (6), и повышенному расходу реагентов на ее нейтрализацию при последующем выделении из раствора кристаллического нитрата натрия.
Время стабилизации рН выбрано из условия достижения равновесия при 70-90ОС. При стабилизации рН в течение менее 15 мин наблюдается неполнота инверсии; при времени более 20 мин затрачивается лишняя энергия на поддержание заданной температуры раствора [17].
2) Изобретение относится к способам получения нитрита натрия и абсорбционным аппаратам для проведения процесса и может быть использовано в химической промышленности и других отраслях хозяйства. Сущность изобретения заключается в том, что абсорбцию горячей газовой смеси, получаемой в результате окисления аммиака и содержащей водяные пары, кислород и окислы азота, водным раствором гидроокиси натрия, ведут в заполненном гидроокисью натрия вертикальном цилиндрическом аппарате, при этом газ и исходный раствор гидроокиси натрия подают в нижнюю секцию абсорбционной зоны и выводят из верхней секции абсорбционной зоны. Процесс ведут в абсорбционном аппарате, который выполнен многосекционным, внутреннее пространство корпуса разделено на верхний и нижний отсеки перегородкой, на которой установлен барботер, а корпус снабжен штуцерами подачи циркуляционного раствора, выхода продукционного раствора и отвода выхлопных газов, верхний отсек разделен ситчатыми тарелками на секции, на высоте 2/3 верхнего отсека установлены,
По меньшей мере, две сепарационные тарелки с переливными патрубками, одна из тарелок сообщается с нижним отсеком аппарата, другая - с нижней частью верхнего отсека, барботер выполнен в виде цилиндра, верхний торец которого снабжен перфорированной отверстиями перегородкой (рис. 10). Изобретение позволяет увеличить выход готового продукта за счет повышения отношения нитрита натрия к нитрату натрия, улучшить качество продукта, так как в отдельных случаях получают нитрит натрия без примеси нитрата натрия, с низким содержанием гидроокиси натрия [18].
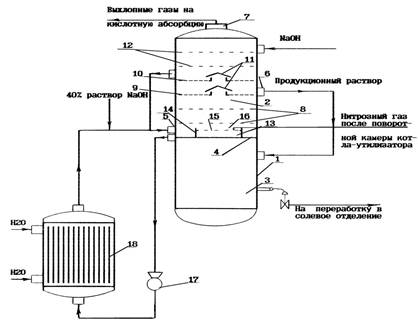
Рис.10
Получение аммиака
1) Способ получения аммиака из углеводородного сырья, водяных паров, воздуха, включает компримирование и очистку сырья от соединений серы, паровую и паровоздушную каталитическую конверсию метана, конверсию оксида углерода, очистку полученной азотоводородной смеси от кислородсодержащих соединений, компримирование, синтез аммиака в замкнутом цикле, использование неочищенного от соединений серы сырья в качестве топлива, утилизацию тепла дымовых газов и выделение их в
Окружающую среду и отличается тем, что часть сырья, равную 0,001-0,048 от количества углеводородного сырья, прошедшего очистку от соединений серы, сжигают в смеси с компримированным воздухом, а полученные дымовые газы в количестве 0,0146-1,685 от количества воздуха, направляемого на паровоздушную каталитическую конверсию метана, подают на паровоздушную каталитическую конверсию метана. Технический результат состоит в уменьшении расхода углеводородного сырья, снижении выбросов в атмосферу и утилизации тепла отходящих дымовых газов [19].
2) Изобретение относится к способу получения аммиака из азота и водорода и может быть использовано в химической промышленности. Аммиак 3 получают из состоящей по существу из азота и водорода газовой смеси 4, полученной из природного газа 5 следующим образом. Из природного газа 5 путем частичного окисления газом 6, обогащенным кислородом, в присутствии водяного пара получают содержащий водород и моноксид углерода неочищенный синтез-газ 7, из которого во время по меньшей мере одной стадии каталитической реакции (сдвига) и превращения части моноксида углерода в диоксид углерода получают конвертированный содержащий водород, диоксид углерода и моноксид углерода синтез-газ 8. Из полученного синтез-газа 8 на по меньшей мере одной стадии декарбонизации по меньшей мере частично удаляют диоксид углерода 20а, а на по меньшей мере одной стадии очистки по меньшей мере частично удаляют моноксид углерода 22а. По меньшей мере на одной стадии очистки конвертированного синтез-газа используют по меньшей мере одно молекулярное сито. Обогащенный кислородом газ содержит по меньшей мере 50% кислорода, а давление, при котором осуществляется частичное окисление, составляет от 40 до 150 бар (рис. 9). Способ позволяет повысить эффективность, снизив при этом расход энергии и эксплуатационные затраты за счет снижения количества исходного углеводородного сырья [20].
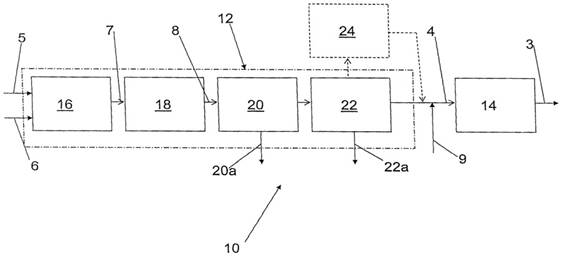
Рис. 9
Получение хлорида аммония
1) Изобретение относится к химической промышленности, а именно к способам получения зернистого хлорида аммония. Сущность способа получения зернистого хлорида аммония заключается во взаимодействии газообразных аммиака и хлористого водорода в присутствии псевдоожижаемого компонента, в качестве которого используют гранулы инертного материала, а взаимодействие газообразных аммиака и хлористого водорода осуществляют, подавая их раздельно в контактный аппарат для создания псевдоожиженного слоя гранул инертного материала, орошаемого водой или раствором хлорида аммония. Заявляемый способ позволяет увеличить выход целевого продукта до 95-97 мас.% и увеличить удельную производительность по готовому продукту за счет увеличения суммарной концентрации исходных реагентов в эквимолекулярном соотношении.
Поставленная задача достигается тем, что в способе получения зернистого хлорида аммония путем взаимодействия газообразных аммиака и хлористого водорода в присутствии псевдоожижаемого компонента, в качестве псевдоожижаемого компонента используют гранулы инертного материала, а взаимодействие осуществляют, подавая газообразные аммиак и хлористый водород раздельно в контактный аппарат, содержащий псевдоожиженный слой гранул инертного материала, орошаемый водой или раствором хлорида аммония [21].
Похожие статьи
-
Выбор метода получения 1 способ Готовят отдельно два раствора: 9 г хлорида кобальта (II) в 25 мл воды (раствор 1) , 10 г хлорида аммония и 14 г нитрата...
-
Аммиакаты на примере хлорида гексаамминкобальта (III) 1) Разлагаются при нагревании: 2) Разлагаются с горячей водой: 3) Реагируют с разбавленными...
-
Общая характеристика комплексов кобальта - Свойства кобальта и его комплексных соединений
Для кобальта характерно образование комплексных соединений. Так, в качестве лигандов при образовании комплексов с кобальтом часто выступают молекулы...
-
Применение кобальта и его комплексных соединений - Свойства кобальта и его комплексных соединений
Кобальт в виде порошка используют в основном в качестве добавки к сталям. При этом повышается жаропрочность стали, улучшаются ее механические свойства...
-
Вещество [Co] Лиганды и Комплексообразователь Координационное число 6 Для комплексов с координационным числом 6 характерно октаэдрическое расположение...
-
Физические и термодинамические свойства кобальта - Свойства кобальта и его комплексных соединений
Кобальт -- твердый, блестящий металл, похожий на железо, существующий в двух модификациях [1]. При температурах от комнатной до 427°C устойчива...
-
ВВЕДЕНИЕ - Свойства кобальта и его комплексных соединений
Соединения кобальта представляют особый интерес, так как из трех основных ферромагнитных металлов - железа, никеля и кобальта - последний обладает...
-
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ, Общая характеристика кобальта - Свойства кобальта и его комплексных соединений
Общая характеристика кобальта Кобальт - элемент побочной подгруппы восьмой группы четвертого периода периодической системы химических элементов Д. И....
-
Методы расчета квантовых выходов - Свойства нейтральной формы гибридного соединения
В изучении фотоизомеризации часто случается так, что продукт реакции нельзя выделить в чистом состоянии, так как невозможно разделить реакционную смесь...
-
Свойства азота - Азот, его соединение и свойства. Азот в природе
Всем известно: азот инертен. Часто мы сетуем за это на элемент № 7, что естественно: слишком дорогой ценой приходится расплачиваться за его относительную...
-
Порфиразины с аннелированными шестичленными N - гетероциклами - пиридиновыми и пиразиновыми кольцами, среди которых первыми были синтезированы...
-
Комплексные соединения, их номенклатура, типы, строение, свойства - Основы химии
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Согласно...
-
Очистка атмосферы от ртути - Ртуть: свойства и токсичность
Существует много процессов выделения, содержащих ртуть газов, не только на предприятиях, производящих ртуть, но также таких процессах, как получение...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Получение, Изотопы, Физические свойства, Химические свойства - Краткие сведения о кобальте
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для...
-
Подготовка сырья. - Переработка твердых отходов промышленных стройматериалов и машиностроения
Механическая обработка, девулканизата. Девулканизация резины. Остающаяся после регенерации РТИ текстильные волокна применяются для получения технической...
-
Химические свойства алюминия и его соединений - Алюминий и его свойства
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид). I. Взаимодействие с простыми...
-
Соединения азота - Азот, его соединение и свойства. Азот в природе
Из почвы соединения азота попадают в растения. Далее: "лошади кушают овес", а хищники -- травоядных живот-ных. По пищевой цепи идет круговорот вещества,...
-
СЫРЬЕ ДЛЯ СЕРНОЙ КИСЛОТЫ И МЕТОДЫ ЕЕ ПОЛУЧЕНИЯ. - Получение серной кислоты
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо...
-
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил притяжения....
-
Этаминал-натрий дает фиолетовую окраску с солями кобальта и изопропиламином. Выполнение реакции. К 2 мл хлороформного раствора исследуемого вещества...
-
Оксид кадмия CdO можно получить сжиганием металла на воздухе или в кислороде, обжигом его сульфида или термическим разложением некоторых соединений. Это...
-
Сырье - смесь углеводородов, обладает высокой испаряемостью при обычной температуре. Огнеопасен. Вдыхание большого количества паров бензина вызывает...
-
Реагирует с неметаллами: 4Al + 3O2 > 2Al2O3 ; 2Al + 3Br2 > 2AlBr3 c оксидами металлов:2Al + Fe2O3 > Al2O3 + 2Fe (алюмотермия)c водой (если...
-
Выводы - Свойства нейтральной формы гибридного соединения
1. Отработана методика синтеза гибридного соединения QD-L на основе квантовой точки CdS (QD) и фотоактивного лиганда -...
-
В разделе 1 курсовой работы требуется: Определить количество закупаемого заданным филиалом фирмы сырья у каждого АО, (xj), максимизируя прибыль филиала....
-
Определение температуры плавления Температуру плавления определяем с помощью малогабаритного нагревательного стола типа "Boetinus" с наблюдательным...
-
Оборудования, используемые для определения ртути Класс опасности - 1, ПДК в населенных пунктах (среднесуточная) -- 0,0003 мг/мі ПДК в жилых помещениях...
-
Водородные соединения, Водородная связь - Свойства водорода
В этой таблице слева легкой тенью выделены клетки элементов, образующих с водородом ионные соединения - гидриды. Эти вещества имеют в своем составе...
-
Общая методика. В круглодонной трехгорлой колбе емкостью 100 мл растворяли 11,9 г бензотриазола (2-аминопиридина) в 20 мл толуола. Колбу соединяли с...
-
Синтез гетероциклических соединений Синтез 4-амино-1,2-бензотиазола К раствору 5-8 г (31 ммоль) 2,6-диметилтолуола в 15 мл мезителена (температура...
-
Спектральные свойства нейтральной формы гибридного соединения QD-L На рис. 28 представлены спектры поглощения растворов исходных квантовых точек CdS...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
Принципы получения гибридных соединений на основе квантовых точек и органических хромофоров В литературе для получения соединений, обладающих...
-
Для получения монокристаллов арсенида индия с высокими и стабильными электрофизическими параметрами необходимо использовать высокочистые исходные...
-
Для неметаллов характерно существование газообразных соединений с водородом. У азота таким соединением является аммиак NH3, который состоит из атома...
-
Сплавы Никель является основой большинства суперсплавов -- жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых...
-
Физические свойства, Общая химическая характеристика кадмия - История открытия и свойства кадмия
Кадмий _ Серебристо-белый , отливающий синевой Металл , тускнеющий на воздухе из-за образования защитной пленки оксида. Температура плавления - 321C,...
-
Пиролиз углеводородного сырья в расплавленных средах - Пиролиз углеводородного сырья
В качестве расплава употребляют некоторые металлы (свинец, висмут, кадмий, олово и другие) и их сплавы, соли (хлориды, карбонаты и другие) или...
-
Пиролиз в присутствии гомогенных инициаторов - Пиролиз углеводородного сырья
Широкое применение получили различные добавки и инициаторы способные инициировать процесс пиролиза, а также ингибировать нежелательные процессы. В...
МЕТОДЫ ПОДГОТОВКИ СЫРЬЯ - Свойства кобальта и его комплексных соединений