Экспериментальная часть, Определение удельной и молярной электропроводности сульфатных растворов - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов
Определение удельной и молярной электропроводности сульфатных растворов
Методика эксперимента. В исследованиях использовали растворы: 0,1 M CuSO4; 0,01 CuSO4; 0,001 M CuSO4; 0,1 M CuSO4 + 0,99 M Na2SO4; 0,001 М CuSO4 + 0,999 M Na2SO4. Для измерения электрической проводимости раствора прибегали к измерению его сопротивления. Удобная конструкция для измерения электрической проводимости показана на рисунке (2.1). Раствор помещали в специальный сосуд, имеющий два платинированных платиновых электрода (рис. 2.1) Чтобы понизить поляризационное сопротивление, их платинируют. Этим резко повышают площадь поверхности электродов, уменьшая тем самым плотность тока, протекающего через электроды.
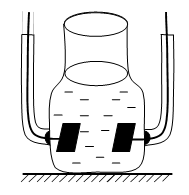
Рис. 2.1. Вид ячейки для измерения электропроводности растворов.
Измерения проводим с использованием переменного тока(с частотой, обычно не выше 105 Гц ), так как достаточно быстрое изменение направления тока служит оптимальным средством для почти полного устранения поляризационного сопротивления. Основой установки является мост Уитстона, образованный контуром из сопротивлений R1 - R4 (рис. 2.2).
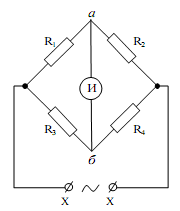
Рис. 2.2. Схема моста Уитстона.
На одну из диагоналей моста подается питание от генератора переменного (синусоидального) напряжения, а на другой диагонали регистрируется сигнал индикатором нуля И, в качестве которого применяли осциллограф. Мост находится в равновесии, т. е. на диагонали аб отсутствует сигнал, если вы полнено условие R1/R2 = R3/R4. Поэтому, если на место R1 поставить сосуд с раствором, а на место R2 - магазин сопротивлений, то при равновесии моста
Rx = R1 = R2R3/R4.2.1
Удельную электропроводность раствора рассчитывали из его сопротивления R по формуле:
= A/R2.2
Постоянную сосуда A определяли по известной удельной электропроводности стандартного раствора KCl, концентрация которого 0,02 M. Для этого заполнив сосуд этим раствором, измеряли его сопротивление RKCl, а затем находили постоянную сосуда:
2.3
Вычисленное значение A использовали в дальнейшем при измерении электрической проводимости воды рабочих растворов электролитов.
Используемым в работе растворителем (дистиллированной водой) или раствором заполняли ячейку (1) (рис. 2.1), измеряли RKCl и рассчитывали удельную электропроводность по формуле 2.2.
Результаты и обсуждение. Расчет показывает, что постоянная сосуда А =0,798 см-1, удельная электропроводность воды Н2О =3,0012?10-6 Ом-1?см-1. Результаты измерений сопротивления R и расчета электропроводности растворов приведены в табл. 2.1.Расчитывали удельную и молярную электропроводности по формулам:
= A/R, 2.2
Лс=1000/C. 2.4
Таблица 2.1. Сопротивление, удельная и молярная электропроводность растворов CuSO4
|
Концентрация |
R, Ом |
, Ом-1см-1 |
Лс, Ом-1см2моль-1 |
|
0,001 |
2700 |
0,00029 |
290 |
|
0,01 |
510 |
0,00156 |
156 |
|
0,1 |
100 |
0,00797 |
79,7 |
Таблица 2.2. Сопротивление, удельная и молярная электропроводность
Водных растворов CuSO4+Na2SO4
|
Растворы |
R ср, Ом |
, Ом-1см-1 |
|
0,001 M CuSO4 + 0,999 M Na2SO4 |
10 |
0,0797 |
|
0,01 М CuSO4 + 0,99 M Na2SO4 |
9 |
0,0886 |
|
0,1 М CuSO4 + 0,9 M Na2SO4 |
7 |
0,1139 |
Анализ результатов из таблицы 2.1 показывает, что удельные электропроводность увеличивается, а молярная понижается с увеличением концентрации. Анализ таблица 2.2 показывает, что удельная электропроводность увеличивается. Это связано c тем, что к раствору CuSO4 добавляют Na2SO4 ,которые является фоновым электротролитом (т. е Na2S04 будет определять миграционный перенос).Тогда CuSO4 не будет участвовать в миграции. Конвекция в нашем случае исключена, так как мы не нагревали и перемешивали наш раствор. Тем самым мы создаем условия для диффузионного переноса.
Похожие статьи
-
Методика эксперимента. Кислотность рабочих растворов определяли с помощью хингидронного электрода. Хингидронный электрод представляет гладкую платиновую...
-
Удельная электропроводность раствора увеличивается, а молярная - понижается с увеличением концентрации. При добавление раствору CuSO4 Na2SO4 , удельная...
-
Методика эксперимента. Простейшая электролитическая ячейка, которая может быть использована для снятия поляризационных кривых, представлена на рис. 2.5...
-
Кинетика электродных процессов. Электродным процессом называется сумма всех изменений, происходящих во времени на поверхности электрода при потенциале,...
-
Введение - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов
С развитием современной металлообрабатывающей промышленности и непрерывным ростом ассортимента изделий из металлов постоянно расширяется область...
-
Иодометрический метод определения концентрацииCu2+-ионов в растворе Концентрацию в растворах определяли иодометрическим методом в коническую колбу...
-
Оборудования, используемые для определения ртути Класс опасности - 1, ПДК в населенных пунктах (среднесуточная) -- 0,0003 мг/мі ПДК в жилых помещениях...
-
Приготовление растворов - Расчеты при приготовлении водных растворов
Концентрация растворов Масса раствора состоит из массы вещества и массы воды, т. е. Концентрация раствора Для дезинфекции чаще всего используются...
-
Органические кислоты применяются при разложении минерального сырья лишь в единичных случаях, главным образом в фазовом анализе. Наиболее часто для...
-
В сухую колбу Кьельдаля вносят 0,1 г исследуемого продукта, наливают 5 см3 концентрированной серной кислоты. Добавляют небольшое количество катализатора....
-
Электролиз - физико-химический процесс, состоящий в выделении на Электродах составных частей растворенных веществ или других веществ, который возникает...
-
Экспериментальная установка В работе используется прибор для текстурных измерений "Термосорб" серии М, фирмы "КАТАКОН" Серийный №017 Дата выпуска...
-
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ - Характеристика основных видов растворов
В насыщенном растворе малорастворимого сильного электролита устанав-ливается равновесие между твердой фазой (осадком) и ионами электролита: ВaSO4 (в...
-
Поляриметр. Удельное вращение - Оптические изомеры и их влияние на организм человека
Различить оптические изомеры можно с помощью поляриметра - прибора, измеряющего угол поворота плоскости поляризации. Величину оптической активности...
-
Диспергированием называют тонкое измельчение твердых мате-риалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате...
-
Определение атомных масс - Великие открытия Йенса Якоба Берцелиуса
Работы Берцелиуса были направлены на определение атомных масс. Ему удалось идентифицировать атомные массы 45 химических элементов, которые в 1818 были...
-
Важнейшей характеристикой раствора является его состав. Содержание растворенного вещества в растворе может быть выражено безразмерными единицами (долями...
-
Минеральные кислоты, используемые для переведения анализируемой пробы в раствор, разделяют на две основные группы. 1) Кислоты, не оказывающие...
-
Определяли динамическую обменную емкость, полную динамическую обменную емкость и степень отмывки смолы КУ-2 от Cu2+-катионов 5% раствором серной кислоты....
-
Парентеральные вмешательства - Расчеты при приготовлении водных растворов
Введение инсулина Инсулин - гормон поджелудочной железы, назначающийся пациентам, страдающим сахарным диабетом. Один миллилитр инсулина содержит сорок...
-
Описание процессов, происходящих на поверхности, изобилует специальными терминами, и при рассмотрении адсорбционных явлений приходится говорить на языке,...
-
Растворимость солей, кислот и оснований в воде, Ионное произведение воды - Ионные реакции
Таблица. Таблица растворимости солей, кислот и оснований в воде Катион Анион H+ NH4+ K+ Na+ Ag+ Ba2+ Ca2+ Mg2+ Zn2+ Cu2+ Hg2+ Pb2+ Fe2+ Fe3+ Al3+ OH- P P...
-
СЛАБЫЕ ЭЛЕКТРОЛИТЫ - Характеристика основных видов растворов
При растворении в воде слабого электролита устанавливается динамическое равновесие между недиссоциированными молекулами и продуктами их диссоциации -...
-
Методы очистки коллоидных растворов - Методы очистки и получения коллоидных растворов
При получении коллоидных растворов тем или иным методом, особенно с помощью химических реакций, практически невозможно точно предусмотреть необходимое...
-
Общая схема исследования: 1. Составление среднего образца. 2. Извлечение пестицидов из пробы. 3. Очистка экстракта. 4. Анализ экстракта. Прием образцов в...
-
ВНУТРИЛАБОРАТОРНЫЙ КОНТРОЛЬ - Метод определения хлорсодержащих пестицидов
В нашей лаборатории, как и в любой аккредитованной лаборатории, существует система качества и в том числе система качества выполнения анализа, поэтому...
-
МЕТОДЫ ОСАЖДЕНИЯ, ИОННОГО ОБМЕНА, МЕМБРАННЫЕ МЕТОДЫ - Химические свойства и строение воды
Современные технологии позволяют изготавливать объемные или плоские фильтрующие материалы с однородными каналами практически любого размера. Мембранный...
-
Испытания на чистоту, Количественное определение - Аскорбиновая кислота
В качестве допустимых примесей рассматривают сульфатную золу (не более 0,1 %) и тяжелые металлы (не более 0,001 %). Содержание органических примесей...
-
Определение разрешающей силы зрительных труб - Разрешающая способность зрительной трубы
Для определения разрешающей силы объективов зрительных труб пользуются специальными штрихованными таблицами - мирами (рис. 6).Мира представляет собой...
-
Итак, в первых двух разделах курсовой работы мы использовали модуль Excel "Поиск решении" для решения задачи общего линейного программирования (1 раздел)...
-
Основные понятия и определения проблемы прогнозирования - Прогнозирующие системы
Необходимо отметить, что мы рассматриваем прогнозирование в целях планирования производства или управления запасами. Таким образом, наш интерес лежит в...
-
В разделе 1 курсовой работы требуется: Определить количество закупаемого заданным филиалом фирмы сырья у каждого АО, (xj), максимизируя прибыль филиала....
-
Экспериментальная факторная модель процесса акусто-магнитной обработки топлива
Всевозрастающее воздействие человека на природу привело к возникновению экологических проблем в экосистеме биосферы, в частности, проблемы загрязнения...
-
Теплоотдача при пленочной конденсации водяного пара - Выпаривание раствора хлорида калия
Для водяного пара в случае конденсации на пучке горизонтальных труб осредненный по всему пучку коэффициент теплопередачи можно рассчитать по формуле:...
-
Расход теплоты на подогрев исходного раствора от температуры t'Нач до температуры tНач найдем по формуле (10), приняв значение теплоемкости раствора при...
-
Аналитический обзор - Выпаривание раствора хлорида калия
Устройство выпарных аппаратов. Разнообразные конструкции выпарных аппаратов применяемых в промышленности, можно классифицировать по типу поверхности...
-
В аргентометрии применяют различные способы установления точки эквивалентности как с помощью индикаторов, так и без них. Метод равного помутнения. Идея...
-
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ - Характеристика основных видов растворов
В водных растворах сильные электролиты полностью диссоциированы, поэтому даже при малых концентрациях растворов энергия электростатического...
-
Использованная аппаратура и методика экспериментов В качестве растворителей при проведении фотолиза в работе использовались хлороформ (х. ч.) и...
-
Автоматизированная обработка на ЭВМ позволяет составлять различные сводки, таблицы, ведомости, где информация сгруппирована по каким-либо...
Экспериментальная часть, Определение удельной и молярной электропроводности сульфатных растворов - Диффузионная кинетика катодного осаждения купрума из водных сульфатных растворов