Анализ удобрений - Агрохимический анализ почв, растений, удобрений
Определение видов и форм некоторых минеральных удобрений по качественным реакциям
- 1. Простые минеральные удобрения могут быть Кристаллическими (к ним относятся все азотные, кроме цианамида кальция и все калийные) и Аморфными (к ним относятся все фосфорные удобрения и известковые материалы). 2. Растворимость в воде: кристаллические удобрения заметно растворимы либо полностью растворимы. Аморфные удобрения, как правило, слабо растворимы или нерастворимы. 3. Гранулометрический состав: азотные удобрения выпускаются в гранулах и покрыты слабой легкорастворимой гидрофобной пленкой, за исключением цианамида кальция, сульфата - и хлорида аммония; калийные - в виде крупных кристаллов белого или розового цвета (хлорид калия) или мелкокристаллических порошков с серым оттенком - все остальные. Простые фосфорные удобрения представлены матовыми гранулами серо-белого цвета различных оттенков и аморфными порошками, известковые материалы - аморфные порошки различной тонины помола, сложные и комплексные удобрения - матовыми гранулами беловато-серовато-розового оттенка. 4. В состав кристаллических удобрений входят следующие ионы, которые достаточно легко определяются качественными реакциями:
NH4+ K+,. Ca2+, Na+, SO42-, NO3-, Cl-
Для открытия иона NH4+ используют реакцию удобрения со щелочью, выделение в этой реакции аммиака при нагревании устанавливается по запаху.
NH4N03 + NaOH = NaNO3 + NH3^ + H2О
Присутствие иона NO3- устанавливается с помощью дифениламина, который при взаимодействии с нитрат-ионом образует в растворе соединения синего цвета. Для открытия сульфат-иона используют реакцию с хлоридом бария:
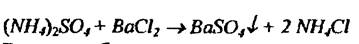
Выпадает белый кристаллический осадок. Образовавшийся осадок растворяется под действием соляной и уксусной кислоты. Присутствие K+,. Ca2+, Na+ обнаруживают по окраске пламени: кусочек удобрения помещают на раскаленную деревянную пластинку и вносят в пламя горелки: калийные соли, особенно селитра, вспыхивают и окрашивают пламя в фиолетовый цвет, натриевые соли - в желто-оранжевый, кальциевые вспыхивают и сгорают, не окрашивая пламени.
Определение в удобрениях содержания аммиачного азота методом открытого кипячения
Определение основано на том, что при кипячении раствора удобрения, содержащего азот в аммонийной форме, с раствором щелочи образующийся аммиак улетучивается. Его количество эквивалентно количеству щелочи вступившей в реакцию.
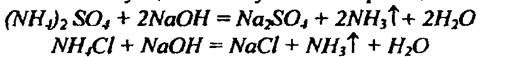
Избыток щелочи, не вступившей в реакцию, оттитровывают кислотой соответствующей нормальности. В работе используются растворы кислоты и щелочи точно установленной нормальности.
Ход анализа
- 1. Растереть в фарфоровой ступке 30-40 г аммиачного удобрения. 2. Взять на технических весах навеску 10 г (в двукратной повторности), перенести в химический стакан объемом 150-200 мл, растворить в дистиллированной воде, размешивая стеклянной палочкой. 3. Отфильтровать раствор в мерную колбу емкостью 200 мл через воронку диаметром 8-10 см с бумажным обычным фильтром, довести водой до метки, закрыть и взболтать. 4. Взять пипеткой 25 мл фильтрата в колбу коническую объемом 100 мл, прилить к нему из бюретки 50 мл 0.5 н. раствора щелочи. 5. Перемешать раствор, закрыть маленькой воронкой (диаметром 2-2.5 см), кипятить на электроплитке или горелке, упаривая раствор до 1/3 первоначального объема под тягой. 6. Раствор охладить до комнатной температуры, стенки воронки и колбы омыть холодной дистиллированной водой из промывалки. 7. Оттитровать избыток щелочи 0.5 н. раствором H2SO4 из бюретки прибавив 2-3 капли фенолфталеина, до перехода малиновой окраски к бесцветной.
Расчет
Содержание N
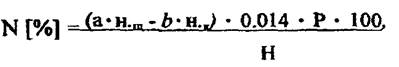
Где: а - количество щелочи, прилитое к раствору удобрения, мл; н. щ.-нормальность щелочи; b - количество серной кислоты пошедшей на титрование, мл; н. к.- нормальность серной кислоты; Р - разведение 200/25=8; 0 014 - мг-экв азота; Н - навеска удобрения, г;
Реактивы
- 1. 0.5 н. раствор щелочи (КОН или NaOH) готовят из фиксанала или 28.06 г NaOH растворяют в дистиллированной воде и доводят объем до 1 литра. 2. 0.5 н. раствор серной кислоты готовят из фиксанала или 14 мл конц. H2SO4 Прилить к 200-300 мл дистиллированной воды и довести объем до 1 литра. 3. Фенолфталеин. 1 %-ый раствор фенолфталеина в этиловом спирте, ректификате.
Нормальность растворов в данном анализе устанавливается с точностью 0.0001 н.
Похожие статьи
-
Введение - Агрохимический анализ почв, растений, удобрений
Агрономическая химия изучает гл. обр. вопросы азотного и минерального питания с.-х. растений с целью повышения урожая и улучшения продукции. Таким...
-
Нитроген в почве - Нитраты и растения
Растения усваивают азот и зольные элементы из почвы в форме минеральных солей, растворенных в почвенном растворе. При этом используются как...
-
Выполнение реакции: Реактив - хлорид железа (III) (раствор, содержащий иодид калия). Для его приготовления к 3 мл 10%-го раствора хлорида железа (III)...
-
В качестве предмета исследования в этом разделе выберем зависимость урожайности (У) от фактора (Х - внесение органических удобрений на 1 га). Таблица 4.1...
-
По данным о прибыли хозяйств района Таблица 3.1 Исходные данные Наименование хозяйств Урожайность, ц/га Стоимость внесенных удобрений на 1 га ТОО Рассвет...
-
Особенности анализа органических соединений
Особенности анализа органических соединений: - Реакции с органическими веществами протекают медленно с образованием промежуточных продуктов. -...
-
Реакция с реактивом Марки. К сухому остатку на фарфоровой чашке добавляют 1 каплю реактива Марки, наблюдают лимонно-желтое окрашивание, переходящее при...
-
Задачи и методы качественного анализа - Основы аналитической химии
Обнаружение или, как иногда говорят, "открытие" отдельных элементов или ионов, входящих в состав веществ - это задачи качественного анализа. Качественный...
-
Этаминал-натрий дает фиолетовую окраску с солями кобальта и изопропиламином. Выполнение реакции. К 2 мл хлороформного раствора исследуемого вещества...
-
Раствор кислоты аскорбиновой 5% (концентрированный раствор) Определение подлинности 1. К 4-5 каплям р-ра прибавляют 2-3 капли р-ра нитрата серебра;...
-
Методы анализа - Свойства флавоноидов
Качественное определение. Для обнаружения флавоноидов в ЛРС используют химические реакции и хроматографию. Химические реакции подразделяются на цветные и...
-
Задачи и методы количественного анализа - Основы аналитической химии
Количественный анализ - это совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих...
-
АНАЛИТИКА Компиляция выдержек из различных источников - удельная б-активность U235 и U238 составляет соответственно 0,08 и 0,012 Бк/мкг (или 80 и 12...
-
При кипячении с разведенной хлороводородной кислотой происходит процесс гидролиза с образованием бензгидрола: Обнаружение димедрола методом ТСХ....
-
Полимеризация двуокиси азота. Переработка нитрозных газов в азотную кислоту обычно происходит при температурах от О до 50 °С. В этих условиях двуокись...
-
На хроматографической пластинке, покрытой закрепленным тонким слоем силикагеля, отмечают линию старта, на которую наносят каплю хлороформной вытяжки из...
-
Это метод который нашел мировое применение для анализа лекарствнных средств. Он основан на свойстве галогенидов количественно осаждаться нитратом серебра...
-
Выполнение реакции. Реактив - хлорцинкиод. В первой склянке растворяют 2 г хлорида цинка в 10 мл воды (раствор А). В другой склянке растворяют 2,1 г...
-
Выполнение реакции. В делительную воронку вносят 0,1 мл раствора исследуемого вещества, прибавляют 0,2 мл 0,1%-го раствора родамина 6Ж и 1мл...
-
Запасы этих растворов, несоответствующих показателям качества, исчисляются сотнями тысяч тонн и дальнейшее их хранение становится очень опасным для...
-
Метод дихотомии требует менее всего итераций цикла для получения корней уравнения с заданной точностью. Если расчет ведется без помощи ЭВМ, то это...
-
ОПЫТ 6. ФТОРОВОДОРОД, ПОЛУЧЕНИЕ И СВОЙСТВА, ОПЫТ 7. АНАЛИЗ ГАЛИДОВ - Свойства галогенов
Смешать в медном или свинцовом тигле 0,5 г фторида кальция и 0,1 г гипса (сульфата кальция), прилить 1 мл концентрированной серной кислоты и быстро...
-
Физическая сущность методики В связи с отсутствием у нейтронов электрического заряда они проходят в веществе без взаимодействий сравнительно большие...
-
В процессе проведения выборочного наблюдения, как и вообще при анализе данных любого обследования, статистика выделяет два вида ошибок: регистрации и...
-
Понятие о выборочном наблюдении и его значение Под Выборочным наблюдением Понимается такое несплошное наблюдение, при котором статистическому...
-
Сущность индекса, их виды Индексы относятся к важнейшим обобщающим показателям. Слово "индекс" имеет несколько значений: показатель, указатель, опись,...
-
Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия,...
-
Адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. Толщи горных пород и почвы являются огромными колоннами с...
-
Нитроген и растения - Нитраты и растения
Эпиграфом для нашей команды стал девиз организации "Гринпис": "Мы не получили Землю в наследство от родителей, мы одолжили ее у наших детей". Живыми...
-
Количественный анализ - это совокупность, химических, физико-химических и физических методов определения количественного соотношения компонентов,...
-
После получения матриц спектра плана, проведем 70 опытов в каждой точке. По полученным параметрам построим регрессионную модель второго порядка,...
-
Анализ эффективности систем массового обслуживания с ожиданием - Теория массового обслуживания
Система с ограниченной длиной очереди. Рассмотрим n - канальную СМО с ожиданием, на которую поступает поток заявок с интенсивностью л=14/час;...
-
Показатели Результаты исследования Гидрокарбонаты ПАВ Фосфаты Сульфаты Проба №1 (пос. Кирпичное) Отсутствуют 0,085 Осадок бурого цвета Отсутствуют Проба...
-
Анализ условий образования эффективных объединений предприятий молочного подкомплекса АПК
Анализ условий образования эффективных объединений предприятий молочного подкомплекса АПК Несбалансированный процесс взаимоотношений между...
-
Гомоскедастичностью называется выполняемость предпосылки о постоянстве дисперсии отклонений. Гетероскедастичностью называется невыполняемость этой самой...
-
После проведения регрессионного анализа получается модель объекта исследований в виде некоторой функции. В простейшем случае линейной регрессии она имеет...
-
Основные предпосылки регрессионного анализа - Основы научных исследований
Методика РА создана с использованием некоторых предпосылок. Если они не выполняются, то корректное выполнение всех процедур РА приведет к неверным...
-
Общие индексы - Статистические индексы в анализе движения цен
Общие индексы рассчитывают для количественных и качественных показателей. В зависимости от цели исследования и наличия исходных данных используют...
-
Моделирование в условиях противодействия, игровые модели - Основы теории систем и системного анализа
Как уже неоднократно отмечалось, системный анализ невозможен без учета взаимодействий данной системы с внешней средой. Ранее упоминалась необходимость...
-
Выбор группировочных признаков всегда должен быть основан на анализе качественной природы исследуемого явления. Всесторонний теоретико-экономический...
Анализ удобрений - Агрохимический анализ почв, растений, удобрений