Свойства воды - Вода и водные ресурсы
Наиболее полно изучены свойства воды, благодаря которым возникла жизнь. Эти свойства сделали возможным существование живой природы в том диапазоне температур, который характерен для Земли как космического тела. Какие же это свойства?
Среди необозримого множества веществ вода с ее физико-химическими свойствами занимает совершенно особое, исключительное место. Это надо понимать буквально. Почти все физико-химические свойства воды -- исключение в природе. Она действительно самое удивительное вещество на свете. Она удивительна не только многообразием изотопных форм молекулы и не только надеждами, которые связаны с ней как с неиссякаемым источником энергии будущего. Она удивительна своими самыми обычными свойствами. Простое химическое соединение с простейшей формулой Н2О заняло особое место на нашей чудесной планете благодаря изумительному сочетанию необычайных свойств.
Физические свойства
Вода обладает рядом необычных особенностей:
- - При таянии льда его плотность увеличивается (с 0,9 до 1 г/см?). Почти у всех остальных веществ при плавлении плотность уменьшается. - При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании - плотность падает. Благодаря этому могут жить рыбы в замерзающих водоемах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остается на поверхности и замерзает, а подо льдом сохраняется положительная температура. - Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг), по сравнению с соединениями водорода с похожим молекулярным весом. - Высокая теплоемкость жидкой воды. - Высокая вязкость, высокое поверхностное натяжение.
Термодинамические свойства воды
Вода имеет особенные, аномальные свойства. В первую очередь это касается таких термодинамических констант, как теплоемкость воды, теплота парообразования, скрытая теплота плавления льда. Аномальный характер этих величин определяет большинство физико-химических и биологических процессов на Земле.
Удельная теплоемкость воды составляет 4,1868 кДж/(кг-К), что почти вдвое превышает удельную теплоемкость таких веществ, как этиловый спирт (2,847), растительное масло (2,091), парафин (2,911) и многие другие. А это значит, что при нагревании на одинаковое количество градусов вода способна воспринять почти вдвое больше тепла, чем перечисленные жидкости. Но и при остывании вода отдает больше тепла, чем другие жидкости. Поэтому при нагревании вод Мирового океана под воздействием солнечных лучей и их остывании при отсутствии энергии солнечной радиации теплоемкость выступает как свойство, обеспечивающее минимальные колебания температуры воды днем и ночью, летом и зимой.
Аномально высокое значение имеет теплота парообразования воды. Эта величина более чем вдвое превышает теплоту парообразования этанола, серной кислоты, анилина, ацетона и других веществ. Поэтому даже в самое жаркое время вода испаряется крайне медленно, что способствует ее сохранению и, следовательно, сохранению жизни на Земле. Высокое значение скрытой теплоты плавления льда также обеспечивает стабильность температурного режима на планете.
Свойства чистой воды
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причем положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные -- атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода -- хороший изолятор. Но поскольку вода -- хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить ее чистоту.
Вода имеет показатель преломления n = 1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния
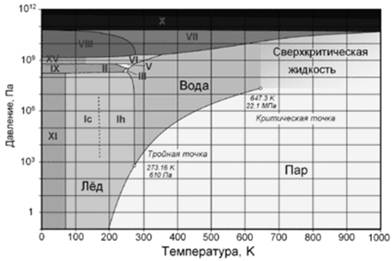
Фазовая диаграмма воды: по вертикальной оси -- давление в Па, по горизонтальной -- температура в Кельвинах. Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки. Римскими цифрами отмечены различные структурные модификации льда.
При атмосферном давлении вода замерзает (превращается в лед) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растет, а температура кипения -- падает.
При давлении в 611,73 Па (около 0,006 атм.) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лед превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растет, плотность водяного пара в точке кипения тоже растет, а жидкой воды -- падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм.) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают.
При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения. Так же возможны метастабильные состояния -- пересыщенный пар, перегретая жидкость, переохлажденная жидкость.
Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлажденную жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лед.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: легкая вода (просто вода), тяжелая вода (дейтериевая), сверхтяжелая вода (тритиевая).
Похожие статьи
-
Что такое вода - Вода и водные ресурсы
Вода (оксид водорода) -- прозрачная жидкость, не имеющая цвета (в малом объеме), запаха и вкуса. Химическая формула: Н2O. В твердом состоянии называется...
-
Охрана водных ресурсов - Геологическое строение и горно-геологическая характеристика месторождения
Водная среда включает поверхностные и подземные воды. Поверхностные воды в основном сосредоточены в океане, содержанием 1 млрд. 375 млн. кубических...
-
Водные ресурсы суши: проблема пресной воды - Обеспеченность ресурсами
Проблема в том, что главным источником удовлетворения потребностей человечества в пресной воде были и остаются речные (русловые) воды, определяющие...
-
Теплофизические свойства - Основные понятия и сведения о физических показателях горных пород
Теплофизические свойства горных пород являются показателями теплового поля Земли, формирование которого обусловлено тремя основными источниками: А)...
-
Природные ресурсы, Агроклиматические, Водные ресурсы - Географическое положение Таиланда
Агроклиматические Климат Таиланда -- влажный тропический и субэкваториальный. Выделяют два основных типа климата в стране -- тропический климат саванны и...
-
Водные ресурсы суши - География мировых природных ресурсов
Вода, как и земля, - совершенно необходимое условие жизни человека, удовлетворяющее его физиологические и санитарно-гигиенические потребности. Хорошо...
-
Реки - Водные ресурсы Байкальского региона
На территории Бурятии насчитывается более 25 тыс рек суммарной длиной около 125 тыс. м. 9% рек относятся к категории самых малых (при длине более 10 км),...
-
Водные ресурсы Республики Бурятия - Водные ресурсы Байкальского региона
К водным ресурсам относятся реки. За счет поверхностных вод удовлетворяется до 90% потребностей народного хозяйства республики. Самым крупным...
-
Свойства - Предупреждение образования гидратов природных газов
Основными свойствами газовых гидратов, необходимыми при моделировании их существования в природе, следует считать следующие: - теплофизические...
-
Состав и свойства нефти, газа и воды - Пермо-карбоновая залежь Усинского месторождения
По I объекту пермо-карбоновой залежи отобраны и исследованы 5 проб нефти. Пластовая нефть недонасыщена газом (давление насыщения 6,9 - 7,4 МПа, ниже...
-
Рис. 14. Влияние угловой скорости шарошечного долота на начальную механическую скорость бурения и углубление за один оборот Рис. 15. Влияние расхода...
-
Водные ресурсы - Общая характеристика природно-ресурсного потенциала Кемеровской области
Речная сеть Кемеровской области принадлежит системе реки Обь. Основная река Томь и ее наиболее крупные притоки (Бельсу, Уса, Мрассу, Тутуяс, Кондома,...
-
Подземные воды - Водные ресурсы Байкальского региона
Выделены четыре пояса подземных стоков, отличающиеся различными условиями пространственно-временного распределения и формирования подземного стока:...
-
Использование водных ресурсов - Водные ресурсы Байкальского региона
Гидросфера (водные ресурсы) играет решающую роль в социально-экономической сфере. Природопреобразующая хозяйственная деятельность в пределах бассейна оз....
-
Водные ресурсы озера Байкал, Поверхностные воды - Водные ресурсы Байкальского региона
Поверхностные воды Водосборная площадь оз. Байкал составляет 588092 км2. Из них 45% находится в Российской Федерации, а остальная часть - в Монголии. При...
-
Венгрия целиком расположена в бассейне Дуная, второй по величине после Волги европейской реки. Его протяженность 2850 км. Длина участка русла...
-
Обеспеченность мелиоративных объектов Западно-Казахстанской области водными ресурсами
Обеспеченность мелиоративных объектов Западно-Казахстанской области водными ресурсами Водные ресурсы местных водотоков, включая трансграничные реки Урал,...
-
Охрана водных ресурсов - Особенность разработки месторождения
Водопотребление. Водоотведение объем производственных сточных вод, состав сточных вод, очистка сточных вод. Питьевая вода для обеспечения хозбытовых нужд...
-
Водные ресурсы - Туристско-страноведческая характеристика Японии
Япония покрыта густой сетью коротких полноводных рек, в основном горных. Среди них крупнейшими являются Синано, Тонэ, Китаками и Исикари. На реках...
-
Водные ресурсы - Природно-ресурсный потенциал России
Как правило, под водными ресурсами понимают пригодные для использования массы водоемов и водотоков, а также подземных скоплений влаги, вода (льды) горных...
-
Реки Прибайкалья - Водные ресурсы Байкальского региона
Территория Прибайкальского района имеет хорошо развитую гидрографическую сеть, которая входит в Ангаро-Енисейский район бассейна оз. Байкал, по...
-
Индия имеет большое количество водных ресурсов : реки, ледники, моря и океан. Реки Ганг (2510 км), Брахмапутра(2900 км), Инд(2879 км), Нарбада и другие...
-
Водные ресурсы, Рекреационные ресурсы - Германия
Самая большая река Германии - Рейн, питающийся от огромного веера притоков в предгорьях Альп. Между Бингеном и Бонном эта река прорезает глубокое ущелье...
-
ПРЕДУПРЕЖДЕНИЕ ГАЗОВЫХ, НЕФТЯНЫХ И ВОДНЫХ ПРОЯВЛЕНИЙ - Бурение нефтяных и газовых скважин
Газо-, нефте - и водопро явления. В разбуриваемых пластах могут находиться газ, вода и нефть. Газ через трещины и поры проникает в скважину. Если...
-
Низкие облака - Образование и свойства облаков
Кучевые облака - это отдельные облака в нижнем и среднем ярусах, как правило, плотные и с резко очерченными контурами, развивающиеся вверх в виде...
-
Физико-химические свойства флюидов - Потымецкое куполовидное поднятие
На площади глубинные и поверхностные пробы нефти отобраны из пластов викуловской и тюменской свит. Отбор и исследование нефти проведены ЦЛ...
-
Воздействие человеческого общества на почвенный покров представляет собой одну из сторон общего влияния человека на окружающую среду. На протяжении...
-
Всего проанализировано 92 глубинные пробы из 12 скважин. Величина давления насыщения нефти газом в качественных пробах менялась от 11,84 до 16,1 МПа,...
-
Исследования пластовой нефти месторождения Сазанкурак проводились в лабораториях АОМЭ ТОО "КазНИГРИ", АФ ТОО ЦТИ ННК "Казахойл", а также проанализированы...
-
Фильтрационные свойства грунтов - Основы движения грунтовых вод
Под пористыми материалами понимают твердые тела, содержащие в достаточно большом количестве пустоты, характерный размер которых мал по сравнению с...
-
Породы-коллекторы представлены в основном мелкозернистыми песчаниками и крупнозернистыми алевролитами, которые по разрезу переслаиваются с аргиллитами и...
-
Земельные ресурсы - География мировых природных ресурсов
Переходя к характеристике земельных (почвенных) ресурсов, которые А. Г.Исаченко называет территориальными ресурсами, мы должны прежде всего отметить, что...
-
А) азота; Б) магния; В) меди. Р = 3 Выберите из перечисленных элементов металлы: Ca, Fe, P, Аl, Br, O. А) Ca, P, O; Б) Fe, Al; В) Fe, Al, Br; Г) Ca, Al,...
-
ВЫБОР СВОЙСТВ БУРОВОГО РАСТВОРА - Расчет бурового промывочного раствора
Выбор плотности Выбор плотности бурового раствора регламентирован действующим "Едиными техническими правилами ведения работ при строительстве скважин на...
-
Гидробиологические исследования на реках Кольского полуострова были начаты В. И. Жадиным в 1936 г. на бассейнах рек Варзуги и Умбы (Жадин, 1940)....
-
Сведения о запасах и свойствах пластовых флюидов - Гидравлический разрыв пласта
Физико-химические свойства нефтей, насыщающих углеводородных газов, свободного газа в газовой шапке и свойства пластовых вод Сугмутского месторождения...
-
Свойства гидратов - Гидраты природных газов
Природные газовые гидраты представляют собой метастабильный минерал, образование и разложение которого зависит от температуры, давления, химического...
-
Свойства пластовой нефти и растворенного газа, а также исследования поверхностных проб нефти Фаинского месторождения изучались по результатам анализов,...
-
Свойства технических жидкостей - Геологическая характеристика Гагаринского месторождения
Текучие материалы (флюиды) деформируются непрерывно (иными словами, текут) без разрушения под воздействием постоянного напряжения. Напряжение,...
-
Физико-химические свойства пластовой нефти Пластовые нефти изучались для пластов терригенной толщи нижнего карбона по ограниченному количеству проб, что...
Свойства воды - Вода и водные ресурсы