Формирование различных типов биоценоза - Биологическая очистка сточных вод
Описанные три основные типа биоценоза активного ила формируются в своеобразных экологических условиях, обеспечивающих определенное качество очистки, оговариваемое в проекте БОС. На фоне описанных общих закономерностей биоценоз активного ила на каждом очистном сооружении своеобразен по своей структуре и адаптационным свойствам и уникален, поскольку состав сточных вод и режим эксплуатации каждого конкретного сооружения специфичен, а их конструкция относится к одному из нескольких определенных типов. Таким образом, на формирование биоценоза, его структуру оказывают влияние проектные параметры, состав сточных вод и соблюдение технологического режима эксплуатации очистных сооружений, где решающее значение имеет поддержание необходимого качества и количества активного ила, которые определяются такими показателями как доза ила, иловой индекс, зольность, возраст, прирост ила.
Также при индикаторной оценке процесса биологической очистки следует учитывать и сезонные изменения биоценоза ила, что характерно для небольших сооружений, очищающих менее 10 тыс. м3 сточных вод в сутки. Летний биоценоз активного ила при прочих равных условиях (состав сточных вод, режим эксплуатации сооружений) по видовому составу несколько богаче зимнего. Смена биоценоза по сезонам года происходит по закону гетерогенной сукцессии, однако, на крупных очистных сооружениях, в условиях горячего водоснабжения, сезонные изменения менее значительны.
5 Кинетика химических реакций
Кинетика химических реакций изучает закономерности протекания химических процессов во времени. Следовательно, химическая кинетика -- это учение о скорости химических реакций и зависимости се от различных факторов.
Скорость химической реакции измеряется изменением концентрации реагирующих веществ (моль/л) в единицу времени. Если относить изменение концентрации к бесконечно малому промежутку времени, то можно получить выражение истинной скорости реакции v в данный момент как производной от концентрации С по времени t:
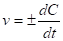
(1)
Если рассматривается изменение концентрации одного из исходных веществ, то производная будет отрицательной величиной, так как в процессе реакции концентрация уменьшается:
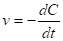
(2)
Влияние концентрации на скорость гомогенных химических реакций описывается законом действия масс: при постоянной температуре скорость данной реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициенту перед формулой данного вещества в уравнении реакции. Этот закон применим для газовых реакций и реакций, протекающих в сильно разбавленных раствотах. Для прямой реакции А+В=АВ закон записывается так:
(3)
Где - скорость реакции; - коэффициент пропорциональности; [А], [В] -- концентрации реагирующих веществ.
Константа скорости реакции равна скорости реакции, когда концентрация каждого из реагирующих веществ равна единице. Для реакции образования воды из водорода и кислорода
2Н2+О2=2Н2О
В зависимости от количества молекул веществ, участвующих в реакции, различают моно-, би-, тримолекулярные реакции. Наиболее часто встречаются моно - и бимолекулярные реакции. Это объясняется тем, что вероятность столкновения одновременно трех молекул чрезвычайно мала.
Важным понятием в химической кинетике является порядок реакций. Он характеризуется суммой показателей степеней концентраций отдельных реагентов в выражении закона действия масс. Различают реакции первого, второго, третьего порядка. Порядок реакции не всегда совпадает с ее молекулярностью. Большинство химических реакций протекает в несколько стадий и скорость реакции характеризуется скоростью наиболее медленно протекающей стадии. Порядок реакции будет выражаться молекулярностью этой стадии и, как правило, отличаться от суммы коэффициентов реакции в целом. Так, в реакциях гидролиза солей в разбавленных водных растворах концентрация воды изменяется так незначительно, что в уравнение скорости реакции она не входит, и кинетика таких реакций будет описываться уравнениями кинетики реакций первого порядка. Реакции разложения молекул, внутримолекулярных группировок (например, диссоциация молекулы хлора на атомы) являются одномолекулярными и относятся к реакциям первого порядка. Скорость одномолекулярной реакции выражается уравнением
(4)
Согласно уравнению 4
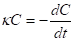
(5)
Где k имеет размерность l/t, или
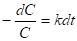
(6)
После интегрирования получаем
LnC=-kt+B (7)
Если начальную концентрацию принять за С0, то можно определить постоянную интегрирования: В=lnC0.
Отсюда
Ln(C/C0)=-kt (8)
C=C0E-kt (9)
Это уравнение характеризует зависимость концентрации от времени для химических реакций первого порядка. Так как в уравнение концентрация вещества входит в виде отношения, то константа скорости реакции первого порядка не будет зависеть от размерности времени. При изменении обеих концентраций в одинаковое число раз интервал времени не будет изменяться, т. е. за одни и те же промежутки времени будет реагировать одна и та же часть взятого количества исходного вещества. Если в первую минуту прореагировала 1/100 часть от общего количества исходного вещества, то через минуту прореагирует столько же от оставшихся 99 частей исходного вещества.
Кинетика реакции второго порядка для равенства концентраций реагирующих веществ описывается уравнением
Kt= (C0-C)/C0C (10)
Если учитывать изменение концентрации реагирующего вещества по времени t, x=C0--С, то t/x=C0--С. Тогда уравнение при-нимает вид
K = x/tC0(C0 -- x) (11)
В отличие от реакций первого порядка величина х в уравнении будет зависеть от того, в каких единицах выражаются время и концентрация реагирующих веществ.
Похожие статьи
-
Режим работы активного ила - Биологическая очистка сточных вод
Суммарный эффект воздействия разнообразных факторов, основным из которых следует считать удельные нагрузки, формирует специфический для каждого очистного...
-
В связи с тем, что обувная фабрика № 1 потребляет большое количество воды на технологические нужды и является источником загрязнения водоемов, проблема...
-
УТИЛИЗАЦИЯ осадков сточных вод и активного ила - Биологическая очистка сточных вод
Утилизация осадков сточных вод и избыточного активного ила часто связана с использованием их в сельском хозяйстве в качестве удобрения, что обусловлено...
-
Основными абиотическими факторами, воздействующими на биоценоз ила, являются: температура, состав очищаемых сточных вод и наличие в них токсичных...
-
Видовое разнообразие организмов активного ила - Биологическая очистка сточных вод
Богатое видовое разнообразие (не менее 25 видов простейших) организмов активного ила свидетельствует о благополучии биологической системы аэротенка,...
-
ПРОЦЕССЫ БИОЛОГИЧЕСКОЙ ОЧИСТКИ - Биологическая очистка сточных вод
Сооружениям биологической очистки отводится главенствующая роль в общем комплексе сооружений канализационной очистной станции. В результате процессов...
-
Источники загрязнения внутренних водоемов - Биологическая очистка сточных вод
Под загрязнением водных ресурсов понимают любые изменения физических, химических и биологических свойств воды в водоемах в связи со сбрасыванием в них...
-
Методы очистки сточных вод - Биологическая очистка сточных вод
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно-бытовые сбросы были невелики,...
-
Процесс полной трехстадийной биологической очистки - Биологическая очистка сточных вод
Процесс полной биологической очистки протекает в три стадии. На первой стадии, сразу же после смешения сточных вод с активным илом, на его поверхности...
-
Биологическая очистка воды, Сооружения и аппараты биологической очистки - Очистка сточных вод
Биологическая Очистка - широко применяемый на практике метод обработки бытовых и производственных сточных вод. В его основе лежит процесс биологического...
-
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод...
-
Фильтрование воды через слой гранулированного угля или введение в воду порошкообразного активного угля являются наиболее универсальными методами удаления...
-
ВВЕДЕНИЕ - Адсорбенты и ионные обменники в процессах очистки природных и сточных вод
Объем потребляемой в мире воды достигает 4 трлн. м3 в год, а преобразованию со стороны человека подвергается практически вся гидросфера. Так при...
-
Основные методы очистки сточных вод - Проблемы загрязнения водоснабжения
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод...
-
20-е столетие характеризуется интенсивным ростом населения Земли, развитием урбанизации. Появились города-гиганты с населением более 10-ти млн. человек....
-
Так как в красильном цеху наблюдается превышение норматива сброса загрязняющих веществ (Прямой черный З, Розовый О, Активный черный С, Хромовый черный О,...
-
Состав сточных вод и основные методы их очистки - Сточные воды и основные методы их очистки
Водоотводящие системы и сооружения - это один из видов инженерного оборудования и благоустройства населенных пунктов, жилых, общественных и...
-
20-е столетие характеризовалось интенсивным ростом населения Земли, развитием урбанизации. Появились города-гиганты с населением более 10-ти млн....
-
Заключение - Биологическая очистка сточных вод
Защита водных ресурсов от истощения и загрязнения и их рационального использования для нужд народного хозяйства - одна из наиболее важных проблем,...
-
Введение - Биологическая очистка сточных вод
Вода - ценнейший природный ресурс. Она играет исключительную роль в процессах обмена веществ, составляющих основу жизни. Огромное значение вода имеет в...
-
Водоотводящие системы и сооружения - это один из видов инженерного оборудования и благоустройства населенных пунктов, жилых, общественных и...
-
Аэротенки - Очистка сточных вод
Для полной биологической очистке сточных вод малых населенных пунктов применяются: аэрационные установки, работающие по методу полного окисления...
-
МОРФОЛОГИЯ МИКРОБОВ - Биологическая очистка сточных вод
В отличие от многообразия макромира (мира больших и видимых невооруженным глазом существ) мир микробов характеризуется относительным однообразием....
-
Основные методы очистки сточных вод - Рациональное использование водных ресурсов
Методы, применяемые для очистки производственных и бытовых сточных вод, можно разделить на три группы: механические; физико-химические, биологические. В...
-
Низкотемпературная термическая регенерация - это обработка сорбента паром или газом при 100-4000С. Процедура эта достаточно проста и во многих случаях ее...
-
Методы регенерации условно можно разделить на три вида: Химический Низкотемпературный термический Термический Химическая регенерация Под химической...
-
Очистные сооружения бытовых сточных вод 1. Технологическая схема станций предусматривает очистку хозяйственно-бытового стока до требований, предъявляемых...
-
Различают природную, сточную и денатурированную воду. Природная вода - это вода, которая качественно и количественно формируется под влиянием...
-
Методы очистки сточных вод - Охрана производственных сточных вод, методы их очистки
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно-бытовые сбросы были невелики,...
-
Выбор оптимальных технологических схем очистки воды - достаточно сложная задача, что обусловлено преимущественным многообразием находящихся в воде...
-
Механическая очистка - песколовки - Очистка сточных вод
Главной задачей, так называемой Песколовки, используемом в ходе очистки и умягчения воды, является выделение крупных и тяжелых частиц (от 200 до 250...
-
Защита водоемов от загрязнений сточными водами, Методы очистки сточных вод - Охрана водных ресурсов
Степень очистки и условия выпуска сточных вод в водоемы регламентируют специальные "Правила охраны поверхностных вод от загрязнения сточными водами"....
-
Водяной пар - Очистка сточных вод производства кальцинированной соды
Для получения пара воду нагревают до температуры кипения, которая зависит от давления получаемого пара. При давлении 760 мм рт. ст. чистая вода кипит при...
-
Обезвреживание и очистка сточных вод. Рациональное использование водных ресурсов - Основы экологии
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно-бытовые сбросы были невелики,...
-
ТЕХНОЛОГИИ ОЧИСТКИ СТОЧНЫХ ВОД - Экология нефтегазодобывающих комплексов
Основная цель водоохранных мероприятий на предприятиях нефтегазокомплекса - минимизация вредного воздействия на водную среду путем эффективной очистки...
-
Биодисковые фильтры - Очистка сточных вод
Эти сооружения предназначены для расхода сточных вод до 1000 куб. м в сутки. В качестве загрузки для биодисковых фильтров рекомендуются перфорированные...
-
Описание технологического процесса Сущность процесса состоит в следующем: очищенный от примесей аммонизированный раствор поваренной соли подвергают...
-
Выпуск сточных вод в водоемы - Сточные воды и основные методы их очистки
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод...
-
Задача очистки вредных сбросов не менее, а даже более сложна и масштабна, чем очистка промышленных выбросов. В отличие от рассеивания выбросов в...
-
В прошлом в качестве загрузочных материалов использовались кварцевый песок и сульфоуголь, однако на сегодня широкий ассортимент синтетических загрузочных...
Формирование различных типов биоценоза - Биологическая очистка сточных вод