Факторы окружающей среды промышленных городов, ухудшающие здоровье населения, и пути их решения
В статье рассмотрены проблемы экотоксикологии, в частности, изменения гонад при острой и подострой интоксикации промышленной пылью. Отмечено, что пыль сложного химического состава г. Темиртау обладает мутагенным эффектом, зависящим от времени воздействия. Авторами приведены данные экспериментальных исследований, доказывающие, что хронические и острые экзогенные интоксикации промышленных химических соединений оказывают прямое и опосредованное влияние на функцию гонад. Определено, что изучаемая пыль г. Темиртау вызывает умеренно выраженные изменения сперматогенеза экспериментальных животных по сравнению с контрольными и нарушение морфологического состоянии сперматозоидов.
Город Темиртау, расположенный на левобережье р. Нуры, в 35 км к северо-западу от г. Караганды, был образован в 1945 г. Ранее на этом месте находился рабочий поселок Самарканд, построенный во время строительства металлургического завода. Население города -- это дети и внуки тех, кто строил завод, мигранты со всей территории бывшего Советского Союза. Такой состав населения характерен и для многих других промышленных городов Республики Казахстан. Территория города занимает 0,3 тыс. км2. По числу жителей Темиртау занимает второе место в области после г. Караганды. Плотность населения в среднем составляет 591,7 [1]. В настоящее время это крупный индустриальный город с развитой инфраструктурой, на территории которого функционирует сложный индустриальный комплекс, представленный базовыми отраслями -- черной металлургией, химической, текстильной промышленностью, производством неметаллических продуктов (коксохимическое производство, производство минеральных удобрений, химических растворителей). Основная часть населения занята на данных предприятиях, что, несомненно, сказывается на их здоровье, а возможно, и на здоровье новорожденных.
Анализ литературы показывает, что одним из показателей экологического состояния популяции является частота врожденных пороков развития среди новорожденных [2, 3]. Предполагают, что это связано с большим вкладом в причины их проявления мутагенных и тератогенных факторов окружающей среды, достаточно высокой частотой встречаемости и простотой диагностики, без больших экономических затрат.
По данным ВОЗ частота врожденных пороков развития (ВПР) в разных странах колеблется от 0,27 до 7,5 % среди новорожденных, 10-25 % -- среди умерших в перинатальном периоде, 70-80 % -- спонтанных абортусов. На территории России и других стран СНГ частота рождений детей с врожденными пороками также значительно изменяется -- от 4 до 50 (%о) врожденных аномалий на 1000 живорождений [4].
В Республике Казахстан, по данным Национального генетического регистра (НГР), частота пороков развития среди новорожденных составляет порядка 14 %о, среди мертворожденных каждый десятый -- из-за ВПР. Такие значительные колебания частоты встречаемости различных аномалий связаны, с одной стороны, с использованием разными авторами различных классификаций ВПР, с другой -- с уровнем медицинской помощи беременным женщинам, а также со степенью развития служб по выявлению пороков. Так, например, чем выше медицинская помощь беременным (следовательно, будет ниже смертность новорожденных от асфиксии, родовых травм, инфекций и т. д.) и чем лучше развиты службы по контролю за проявлением патологии, тем выше будут количество и доля выявленных врожденных пороков [5].
В г. Темиртау можно прогнозировать взаимодействие двух противоположных факторов: с одной стороны, большое генетическое разнообразие популяции, что, по мнению многих исследователей [6-8], положительно сказывается на здоровье потомства; с другой стороны, высокое развитие промышленных предприятий, выбросы которых оказывают отрицательное влияние на здоровье населения.
За период с 1999 по 2005 гг. в г. Темиртау зарегистрировано 72 случая врожденных пороков развития строгого учета (ВПР СУ), что составило 6,42 %о. По отдельным годам происходили колебания частоты врожденных аномалий -- от 3,49 %о в 2005 г. до 11,49 %о в 2002 г. (рис.).
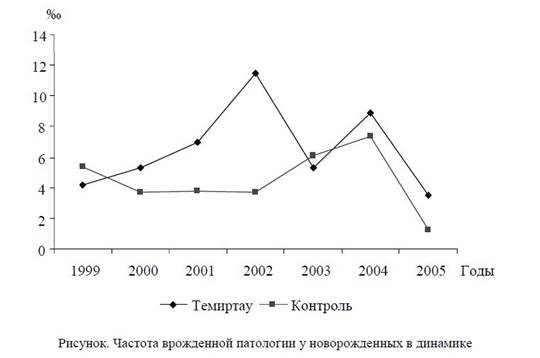
В целом за изученный период в г. Темиртау дети с ВПР СУ рождались в 1,4 раза чаще, чем в контрольном районе. В разные годы наблюдения частота рождения детей с ВПР была различной. Так, в 2002 г. детей с врожденной патологией в г. Темиртау родилось в 3 раза больше, чем за аналогичный период в контрольном районе.
Всего за период с 1999 по 2005 гг. в Юго-Восточной районе г. Караганды (контрольный район) было зарегистрировано 44 случая ВПР (4,45 /), динамика частоты -- от 1,26 / в 2005 г. до 7,39 / в 2004 г. (максимальная частота почти в 6 раз больше минимальной).
Наибольшая разница между частотами ВПР по изученным районам обнаружена в 2002 г. -- 11,49 / в темиртауской популяции и 3,7 / в контрольном районе (в Темиртау в 3 раза чаще). Таким образом, на основе анализа динамики частоты ВПР СУ можно предположить, что в г. Темиртау более интенсивно, чем в контрольном районе действуют какие-либо мутагенные или тератогенные факторы.
Материалы и методы исследования. Согласно поставленной цели и задачам для выявления влияния городской пыли на генетический статус был проведен эксперимент на лабораторных животных. Эксперимент проводился краткосрочный -- в течение 3-х дней и более длительный -- в течение 70 дней (ПДК пыли в дозе 50 мг/м3).
Наиболее распространенным методом изучения мутагенной активности на лабораторных животных является цитогенетический анализ клеток соматической ткани, который был проведен в клетках костного мозга. Поскольку костный мозг представляет собой гетерогенную популяцию клеток, целесообразно с помощью этого объекта изучать мутагенность факторов, а не механизмы повреждений [9]. Метафазный анализ хромосом костного мозга проводился по методу Форда и Воллама [10] в модификации И. Шарипова [11].
Для оценки мутагенности использовался микроядерный тест в полихроматофильных эритроцитах экспериментальных животных [12]. Микроядра представляют собой фрагменты хромосом или целые хромосомы, не включенные в состав ядра в ходе митотического деления клетки. Как правило, образование микроядер провоцируется веществами, вызывающими разрывы хромосом (кластогенные эффекты), и токсикантами, повреждающими белки митотического веретена.
В исследовании использован эпидемиологический подход, который включал ретроспективный учет ВПР по данным областного Национального генетического регистра г. Караганды за период с 1999 по 2005 гг. На каждого ребенка во всех родовспомогательных учреждениях области заполнялась персональная карта (ПКР). Информация, содержащаяся в данной карте, была внесена в компьютерную базу данных. Всего за данный период в г. Темиртау было проанализировано 11213 историй родов. Полученные данные сравнивались с контрольным районом. В качестве контрольного района был взят один из наиболее чистых районов г. Караганды -- Юго-Восток. В контрольном районе за изучаемый период было зарегистрировано 9880 родов.
При анализе структуры врожденных пороков нами была использована адаптированная классификация врожденных пороков развития строгого учета, однозначно диагностируемых врачами любой квалификации [13].
Вычислены частота ВПР по годам исследования и средняя частота за изученный период. Частоту врожденных пороков развития считали в промилле (/) на 1000 рождений.
Для обоснования приведенных данных о заболеваемости населения и выявления фактор-компонентов, действующих на их ухудшение, взяты анализы почвенных покровов, пыли. Проведен ряд экспериментов.
Проведен эксперимент на 42 животных (сроком 2 месяца) по запылению пылью сложного химического состава воздушной среды (г. Темиртау). Интратрахеально затравлено 38 животных пылью сложного химического состава (г. Темиртау). Срок эксперимента 70 дней. Данным животным проводились микроядерный тест, как скрининговый метод выявления мутагенной нагрузки, и тест "открытое поле", с целью выявления нейрофизиологических особенностей поведения животных при воздействии пыли сложного химического состава.
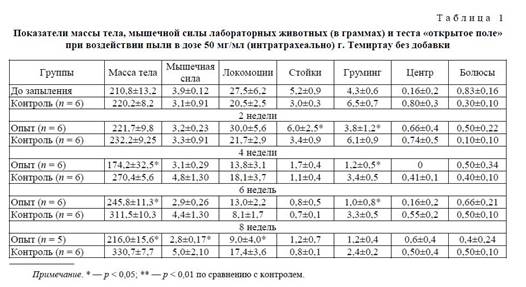
Показатели массы тела, мышечной силы лабораторных животных (в граммах) и теста "открытое поле" при воздействии пыли в дозе 50 мг/мл (интратрахеально) без добавки представлены в таблице 2.
При 70-дневном интратрахеальном затравлении лабораторных животных пылью сложного химического состава (г. Темиртау) в дозе 50 мг/мл были выявлены изменения физиологических показателей исследуемых животных. Анализируя весовой показатель при данной дозе запыления, можно отметить в опытной группе его возрастание в первые 2 недели эксперимента и снижение данного показателя на 4 неделе. К 6-й неделе весовой показатель повышается на 16,5 % по сравнению с первоначальным показателем. К концу эксперимента весовой показатель снижается и достигает практически первоначальных значений. В контрольной группе на протяжении всего эксперимента отмечается равномерное повышение весового показателя. С 4-й недели эксперимента отмечаются достоверно значимые изменения данного показателя (р < 0,01) в опытной группе по сравнению с контролем(табл. 2). В соответствии с таблицей можно отметить, что в опытной группе в первые 2 недели эксперимента наблюдается тенденция к снижению мышечной силы, которое отмечается на протяжении
Всего эксперимента.
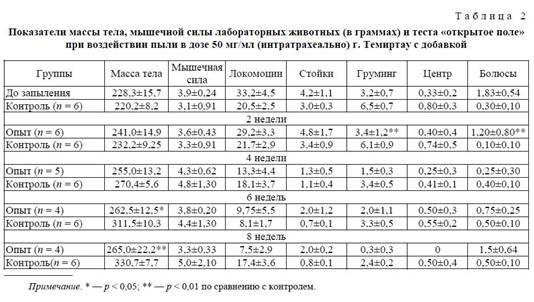
В контрольной группе наблюдалось постепенное физиологическое наращивание мышечной силы. Разница между сравниваемыми группами по показателю мышечной силы достоверна (p < 0,05). До запыления животные показывали достаточно высокий уровень ОИР при минимальных выражениях вегетативных реакций, говорящих об устойчивом типе ВНД с подвижными нервными процессами. экотоксикология промышленный пыль мутагенность
С момента запыления в опытной группе практически все показатели теста "открытое поле" стали явно снижаться. Так, локомоция экспериментальных животных к концу эксперимента достоверно уменьшилась, почти в 2 раза по сравнению с контрольной группой. "Стойки" опытной группы во второй половине эксперимента достоверно снизились по сравнению с первоначальными показателями в 4,2 раза. Данное снижение показателей говорит об уменьшении двигательной активности подопытных животных, как горизонтальной, так и вертикальной, под воздействием отравляющего агента и снижения исследовательского поведения животных. В контрольной группе также отмечается по месяцам снижение данного показателя, но в меньшей степени, чем в опытной группе. Также можно отметить, что "груминг" и "болюсы", как критерии эмоциональной реактивности, на протяжении всего эксперимента изменялись. Показатель "груминг" начал достоверно снижаться с четвертой недели эксперимента. К концу эксперимента данный показатель в контроле превышал в 2 раза опытный показатель. Показатель же "болюсов" в начале опыта снизился в обеих группах. В динамике количество "болюсов" в контрольной группе стало нарастать, в то время как в опытной группе оставалось на приблизительно одинаковых показателях в течение всего эксперимента. К концу эксперимента разница в сравниваемых группах по данному показателю является недостоверной.
Вторую опытную группу, интратрахеально затравленную пылью сложного химического состава г. Темиртау, составили животные, получающие пищевую добавку "свекольные таблетки". В результате проведенных исследований были получены следующие данные. На протяжении всего эксперимента отмечалось достоверное повышение весового показателя как в опытной, так и в контрольной группах (p < 0,05). По показателю мышечной силы отмечается незначительное снижение ко 2-й неделе эксперимента в опытной группе, с дальнейшим увеличением к 4-й неделе. К концу эксперимента данный показатель снизился на 15 % по сравнению с первоначальными данными. Различия между сравниваемыми опытной и контрольной группами были достоверными на протяжении второй половины эксперимента (p < 0,05).
При проведении теста "открытое поле" в данной опытной группе были получены следующие результаты. Двигательная активность подопытных животных на протяжении всего эксперимента снижалась как в опытной, так и в контрольной группах (p < 0,05). Данное снижение показателей говорит о снижении двигательной активности подопытных животных, как горизонтальной, так и вертикальной групп, под воздействием отравляющего агента и снижении исследовательского поведения животных. Также можно отметить, что "груминг" и "болюсы" как критерии эмоциональной реактивности на протяжении всего эксперимента изменялись. Показатель "груминг" начал достоверно снижаться с четвертой недели эксперимента. К концу эксперимента данный показатель в контроле превышал почти в 8 раз опытный показатель. Показатель же "болюсов" в начале опыта снизился в обеих группах. Затем в процессе затравления количество "болюсов" в опытной группе стало нарастать, в то время как в контрольной группе оставалось на приблизительно одном уровне. С 6-й недели разница в сравниваемых группах по данному показателю является достоверной (p < 0,01).
Результаты исследования и их обсуждение. Таким образом, анализируя данные общетоксических показателей при воздействии пыли в дозе 50 мг/мл, можно отметить достоверно значимое снижение веса и мышечной силы животных к концу эксперимента в обеих опытных группах. Более выраженные изменения общетоксических показателей отмечались в группе подопытных животных, не получающих пищевую добавку. Изменения, выявленные при проведении теста "открытое поле", можно интерпретировать как результат интоксикации нервной системы подопытных животных, вызванной воздействием пыли сложного химического состава.
В ходе проведенного эксперимента были интратрахеально затравлены животные (15 крыс) пылью сложного химического состава сроком 3 дня. Время разжижения сперматозоидов в среднем составило 15 минут. В таблице 3 представлены показатели спермограммы экспериментальных животных, подвергавшихся интратрахеальной затравке пылью г. Темиртау (ПДК 50 мг/мл).
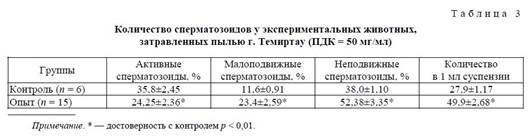
Как видно из таблицы, количество подвижных сперматозоидов в опытной группе при воздействии полиметаллической пыли г. Темиртау было достоверно снижено до 24,25±2,36 % (p < 0,01) по сравнению с контрольной группой -- 35,8±2,45 %, количество малоподвижных сперматозоидов в опытной группе, наоборот, достоверно увеличивалось до 23,4 ± 2,59 % (p < 0,01) по сравнению с контролем -- 11,6±0,91 %.
При анализе общего количества неподвижных сперматозоидов выявлено достоверное увеличение в опытной группе до 52,38±3,35 % по сравнению с контролем -- 38,0±11,08 %. При подсчете количества сперматозоидов в 1 мл суспензии наблюдалось повышение их до 49,9±2,68 усл. ед. (p < 0,001) у опытных животных, а в контроле составляло 27,9±1,17.
Подтверждением данных адаптационных реакций выступает анализ морфологических форм сперматозоидов (табл. 4).

Анализ морфологических форм в контрольной группе показал, что аномалии головок, шейки и хвоста не наблюдается. Лишь в единичном случае встречались сперматозоиды с макроголовкой. У экспериментальных животных, подвергавшихся воздействию пыли сложного химического состава (г. Темиртау, ПДК=50 мг/мл), исследование морфологических форм показало, что в мазках встречается выраженное количество с макроголовкой, повышенное количество лейкоцитов, очень часто встречаются формы с петлеобразными хвостами. Также встречаются сперматозоиды, у которых сросшиеся хвост и шейка в виде восьмерки. Выявлено незначительное количество сперматозоидов с удвоенным хвостом.
Таким образом, у опытных животных, подвергавшихся интратрахеальной затравке пылью сложного химического состава, возрастает количество неподвижных сперматозоидов и снижается количество активных сперматозоидов. Морфологический анализ микроскопических препаратов-мазков суспензии сперматозоидов выявил увеличение патологических форм -- возрастают аномалии головки и хвоста.
В ходе проведенного эксперимента были ингаляционно затравлены животные -- 6 крыс (опытная группа 1) пылью сложного химического состава г. Темиртау (ПДК 0,50 мг/м3) сроком 70 дней с пищевой добавкой в рационе (свекольные таблетки) и 6 крыс (опытная группа 2) при аналогичных условиях, но лишенных пищевой добавки (табл. 5).

Как видно из таблицы 5, количество активных сперматозоидов было достоверно снижено в 1-й опытной группе животных, получавших БАД, -- 30,4±0,12 % (р < 0,01), по сравнению с контролем -- 64,5±3,6 %. У крыс, не получавших БАД (2 опытная группа), количество активных сперматозоидов снизилось в более выраженной степени -- до 18,9±0,55 % (р < 0,001).
Количество малоподвижных сперматозоидов увеличивается в 1 группе животных, употреблявших БАД, -- 26,5±0,40 % по сравнению с контролем -- 20,7±0,40 %, также повышалось у 2-й опытной группы животных, не употреблявших дополнительного к рациону питания -- 24,5±0,16 %.
При анализе количества неподвижных сперматозоидов наблюдается достоверное увеличение во 2-й опытной группе (без БАД) до 28,3±1,45 усл. ед. (р < 0,01) по сравнению с 1-й опытной группой (с БАД) -- 13,75±5,2 усл. ед., что также достоверно превышало контрольные показатели -- 8,4±1,75 усл. ед. Процент неподвижных сперматозоидов в группе животных без употребления БАД превышал контрольные значения на 41,6 %, а в группе животных с БАД -- на 13,5 %. В 1-й опытной группе разница с контролем составила 28,1 %.
Таким образом, при анализе кинезисграммы наблюдается повышение количества неподвижных сперматозоидов у животных, получавших БАД (свекольные таблетки), и еще значительнее возрастало их число у животных, не получавших добавку, по сравнению со здоровыми животными. В группе, где была применена добавка, мы можем свидетельствовать о гипокинетических процессах, а у животных в группе, не получавших добавку, -- о преобладании акинезиса.
В таблице 6 представлены показатели функционального состояния семенников. Количество сперматозоидов в 1 мл спермы достоверно уменьшается у животных 1-й опытной группы до 16,6±0,53 (p < 0,05), у 2-й -- до 21,83±0,8, по сравнению со здоровыми животными -- 27,9±1,17.
Вес семенников аналогично достоверно уменьшается у 1-й опытной группы до 0,976±0,16 мг (p < 0,01), чем у второй опытной группы -- до 1,126±0,12 мг (p < 0,05), по сравнению с контрольной группой, где он составлял 1,314±0,43 мг. Возможно, в связи с этим количество сперматогоний и соответственно сперматозоидов, способных к оплодотворению, невелико. Размеры семенников также снижены в обеих опытных группах (1,77±0,92 см и 1,6±0,17см), по сравнению со здоровыми крысами -- 1,82±0,42.

По данным морфологического анализа (табл. 7) у животных во 2-й опытной группе выявленные аномалии головки сперматозоидов составили 23,0±0,49 усл. ед. (p < 0,01), что достоверно превышало контрольные значения (14,0±0,47 усл. ед.), а в 1-й опытной группе количество патологических форм головок сперматозоидов находилось в пределах нормы (12,5±0,41 усл. ед.).

Случаи выявления аномалии шейки в 1-й и 2-й опытных группах составили соответственно 6,66±0,32 (p < 0,001) и 4,0±0,31 усл. ед. (p < 0,01), по сравнению с контрольными показателями -- 2,0±0,86 усл. ед. Анализ морфологических форм аномалии хвостов сперматозоидов показал, что в обеих опытных группах показатели достоверно превышали контроль на 7,75 и 6,0 усл. ед. соответственно. Следовательно, морфологическая характеристика патологических форм ухудшалась у опытных животных в большей степени, чем у здоровых крыс. Получение пищевой добавки корректировало данные нарушения, и показатели были несколько лучше у экспериментальных животных 1-й опытной группы.
Таким образом, по результатам проведенных исследований можно сделать заключение, что у экспериментальных животных, не получавших БАД, процессы сперматогенеза были более выраженными по сравнению с группой животных, у которых в рационе присутствовала пищевая добавка. Выявлено, что по сравнению с контрольными значениями у обеих исследуемых групп значения были достоверно ниже по всем показателям, что свидетельствует о нарушении функции сперматогенеза.
Проведенные исследования показали, что один из биомаркеров риска в возникновении экологически обусловленной патологии -- нарушения цитогенетической стабильности.
В настоящее время существует ряд цитогенетических методов, выявляющих нестабильность генома и оценивающих влияние мутагенных факторов внешней среды при популяционных исследованиях. Изучение аберраций хромосом остается одним из важнейших критериев загрязнений окружающей среды мутагенами. К данному времени накопилась обширная литература о действии химических веществ на наследственность разных экспериментальных объектов. Экспериментально-генетические работы по индуцированному мутагенезу под влиянием физических факторов, особенно ионизирующей радиации, химических и биологических мутагенов на разных объектах, в том числе клетках человека с разными типами мутаций, позволяют экстраполировать основные выводы на человека.
Мутагенный эффект изучаемой пыли г. Темиртау был выявлен на основании микроядерного теста и определения хромосомных аберраций в костном мозге лабораторных животных. Результаты исследования показали, что у экспериментальных животных отмечаются повышенный уровень микроядер и частота хромосомных аберраций. Среди хромосомных аберраций преобладают поломки хро-матидного типа, что характерно для химического мутагенеза. Выявлена зависимость мутагенного эффекта изучаемой пыли от времени воздействия и приема пищевой добавки.
На основе данных проведенных экспериментальных исследований доказано, что хронические и острые экзогенные интоксикации промышленных химических соединений оказывают прямое и опосредованное влияние на функцию гонад. Изучаемая пыль г. Темиртау вызывает умеренно выраженные изменения сперматогенеза экспериментальных животных по сравнению с контрольными животными и нарушение морфологического состоянии сперматозоидов.
Анализ кинезисграммы показал рост неподвижных сперматозоидов у животных, получавших БАД (свекольные таблетки), еще больший -- у животных, не получавших добавку (по сравнению со здоровыми животными), подвергавшихся запылению пылью сложного химического состава (г. Темиртау). В группе, где была применена добавка, мы можем свидетельствовать о гипокинетических процессах, а у животных в группе, не получавших добавку, -- о преобладании акинезиса. Большей глубине опустошения подвержены зрелые отделы сперматогенных клеток (количество сперма-тид и сперматозоидов). Мутагенные факторы, индуцирующие генетические нарушения, вызывают аномалии в строении сперматозоидов, более выраженные при длительном запылении полиметаллической пылью сложного химического состава.
Выводы
- 1. Анализ общетоксических показателей при воздействии пыли в дозе 50 мг/мл показал достоверно значимое снижение веса и мышечной силы животных к концу эксперимента в обеих опытных группах, что является результатом интоксикации нервной системы подопытных. 2. Пыль сложного химического состава г. Темиртау обладает мутагенным эффектом, зависящим от времени воздействия: при длительном влиянии (70-дневном) нарушения более выраженные. Мутагенное действие изучаемой пыли может быть скорректировано приемом пищевых добавок. 3. При увеличении срока воздействия и дозы неблагоприятного фактора (пыль г. Темиртау, 70 дней запыления) отмечаются снижение подвижности и повышение числа патологических форм сперматозоидов, что свидетельствует о нарушении сперматогенной функции экспериментальных животных. 4. Согласно проведенному эксперименту биомаркером риска при развитии химически обусловленной патологии является генетическая нестабильность: увеличение микроядерного теста, возрастание частоты хромосомных аберраций, преобладание поломок хроматидного типа. 5. В исследуемых районах наблюдается тенденция к увеличению частоты врожденных аномалий среди новорожденных. Структура врожденных пороков развития в изучаемых районах отличается: в г. Темиртау в спектре врожденной патологии первое место занимают расщелины губы и неба (2,85 %о), а в контрольном районе -- синдром Дауна (1,11 %о).
Список литературы
- 1. Кузьмина Л. П., Тарасов А. А., Хайбуллина А. З. Клинико-биохимические изменения при воздействии производственных стресс-факторов у шахтеров-угольщиков // Медицина труда и пром. экология. -- 2001. -- № 8. -- С. 42--45. 2. Паранько Н. М., Белицкая Э. Н., Землякова Т. Д. и др. Роль тяжелых металлов в возникновении репродуктивных нарушений // Гигиена и санитария. -- 2002. -- № 1. -- С. 28-30. 3. Осипов А. И., Азизова О. А., Владимиров Ю. А. Активные формы кислорода и их роль в патологии // Успехи биол. химии. -- 1990. -- № 1. -- С. 180-208. 4. Kita T., Ishii K., Yokode M. et al. The role oxidized low density lipoprotein in the pathogenesis. 5. Дубинина Е. Е. Роль АФК в качестве сигнальных молекул в метаболизме тканей при состоянии окислительного стресса // Вопросы мед. химии. -- 2001. -- Т. 7, № 6. -- С. 561-581. 6. Шорин С. С. Некоторые аспекты загрязнения окружающей среды // Сан. гиг. -- № 1-3. -- С. 6. 7. rambler. ru 8. Измеров Н. Ф. Индустриализация и ее последствия для здоровья работающих // Гигиена и санитария. -- 1992. -- № 4. -- С. 11-18. 9. Милишникова В. В., Филимонова М. Н., Лощилов Ю. А. Патогенетические механизмы формирования воспалительно-деструктивных и фиброзных процессов при пылевых заболеваниях легких // Гигиена труда и проф. заболевания. -- 1988. -- № 1. -- С. 5-8. 10. Величковский Б. Т. Проблема профессиональных и экологически обусловленных заболеваний органов дыхания // Гигиена и санитария. -- 1992. -- № 4. -- С. 46-49. 11. Абушахманова А. А. Гормонально-метаболические проявления пылевых заболеваний бронхолегочной системы // Медицина и экология. -- 1999. -- № 2. -- С. 6-8. 12. Величковский Б. Т., Фишман Б. Б. Каталитические свойства пыли как критерий ее профессиональной опасности // Гигиена и санитария. -- 2000. -- № 3. -- С. 25-28. 13. Heppleston A. G. Prevalence and pathogenesis of pheumoconiosis in coal worbers // Environ. Health Perspect. -- 1988. -- 78. -- P. 159-170.
Похожие статьи
-
Методология оценка риска здоровья - Зависимость здоровья населения от загрязнения окружающей среды
При оценке риска здоровью, который обусловливается качеством окружающей среды, принято исходить из следующих теоретических соображений, получивших...
-
Воздействие окружающей среды на здоровье городского населения - Экология города
В большой степени загрязнение атмосферы сказывается на здоровье городского населения. Об этом свидетельствуют, в частности, существенные различия в...
-
Биологические загрязнения и болезни человека. - Загрязнение окружающей среды и здоровье населения
Кроме химических загрязнителей, в природной среде встречаются и биологические, вызывающие у человека различные заболевания. Это болезнетворные...
-
Основные загрязняющие вещества Человек загрязняет атмосферу уже тысячелетиями, однако последствия употребления огня, которым он пользовался весь этот...
-
Автотранспорт Основной вклад в загрязнение атмосферы вносят автомобили, работающие на бензине (в США на их долю приходится около 75 %), затем самолеты...
-
Фотохимический туман (смог) - Загрязнение окружающей среды и здоровье населения
Фотохимический туман представляет собой многокомпонентную смесь газов и аэрозольных частиц первичного и вторичного происхождения. В состав основных...
-
Аэрозольное загрязнение атмосферы - Загрязнение окружающей среды и здоровье населения
Аэрозоли - это твердые или жидкие частицы, находящиеся во взвешенном состоянии в воздухе. Твердые компоненты аэрозолей в ряде случаев особенно опасны для...
-
Тяжелые металлы. - Загрязнение окружающей среды и здоровье населения
Тяжелые металлы (ртуть, свинец, кадмий, цинк, медь, мышьяк,) относятся к числу распространенных и весьма токсичных загрязняющих веществ. Они широко...
-
Пути решения экологических проблем - Влияние загрязнения окружающей среды на человека
Эколого-защитные нормативы направлены на сохранение генофонда Земли, восстановление экосистем, сохранение памятников всемирного культурного и природного...
-
Состояние здоровья населения России - Влияние вредных факторов среды обитания на здоровье населения
Экологические исследования показали, что резкое ухудшение генетической наследственности рождающегося поколения людей вызвано отравлением окружающей среды...
-
Органическое загрязнение. - Загрязнение окружающей среды и здоровье населения
Среди вносимых в океан с суши растворимых веществ, большое значение для обитателей водной среды имеют не только минеральные, биогенные элементы, но и...
-
Воздействие промышленного производства и прочих факторов на окружающую природную среду Территория Ханты-Мансийского автономного округа - Югры занимает...
-
Основными источниками загрязнения почв и земель на территории города Гуково являются: - ООО "Мегаблок" - ОАО "Гуковуголь" - ЗАО "Швея" Оценка...
-
Государственная экологическая политика. Роль Магнитогорской администрации и ММК в сфере улучшения экологической обстановки Распад СССР усугубил кризисное...
-
С позиции самоорганизации в развитии открытых неравновесных систем выделяется плавный (эволюционный) этап, на протяжении которого не происходит серьезных...
-
Всякий водоем или водный источник связан с окружающей его внешней средой. На него оказывают влияние условия формирования поверхностного или подземного...
-
Самолеты - Загрязнение окружающей среды и здоровье населения
Хотя суммарный выброс загрязняющих веществ двигателями самолетов сравнительно невелик (для города, страны), в районе аэропорта эти выбросы вносят...
-
Влияние Оксида углерода на человека. - Загрязнение окружающей среды и здоровье населения
Концентрация СО, превышающая предельно допустимую, приводит к физиологическим изменениям в организме человека, а концентрация более 750 млн к смерти....
-
Влияние звуков на человека. - Загрязнение окружающей среды и здоровье населения
Человек всегда жил в мире звуков и шума. Звуком называют такие механические колебания внешней среды, которые воспринимаются слуховым аппаратом человека...
-
ЗАКЛЮЧЕНИЕ - Зависимость здоровья населения от загрязнения окружающей среды
В результате проделанной работы были рассмотрены теоретические аспекты безопасности жизнедеятельности человека, а также ее экологических вопросов...
-
ВВЕДЕНИЕ - Загрязнение окружающей среды и здоровье населения
Все процессы в биосфере взаимосвязаны. Человечество - лишь незначительная часть биосферы, а человек является лишь одним из видов органической жизни -...
-
Исчезающие виды и здоровье человека - Международное право и охрана окружающей среды
Когда-то идея использования животных в научных исследованиях встречала оппозицию главным образом потому, что это воспринима-лось как пример жестокого...
-
Возможности преодоления некоторых факторов урбанизации - Экология городов и здоровье населения
Сопоставление двух ваpиантов застpойки окpестностей одного из амеpиканских гоpодов восточного побеpежья показало, что компактная застpойка в сpавнении с...
-
Введение, Факторы неблагополучия городов - Экология городов и здоровье населения
Предметом изучения в контрольной работе является экология. Объект изучения - экология городов, влияние различных негативных факторов на экологию города и...
-
Вступление, Ландшафт как фактор здоровья - Окружающая среда и здоровье человека
Все процессы протекающие в биосфере взаимосвязаны. Человечество - лишь незначительная часть биосферы, а человек является лишь одним из видов органической...
-
Уменьшение числа здорового населения Определение понятия "здоровье" находится в центре внимания врачей с момента появления научной медицины и до...
-
1) Перевод транспортных средств на менее токсичные виды топлива и выполнение комплекса мероприятий по снижению выбросов, обезвреживанию вредных веществ и...
-
От загрязнения воздуха страдают животные и растения. Например, отходы медеплавильных заводов - хлор, мышьяк, сурьма - вызывают гибель домашних и диких...
-
Угроза ухудшения состояния окружающей среды (ОС) до критических пределов в настоящее время рассматривается как угроза национальной безопасности любой...
-
Эта среда относится к наиболее сложной как по свойствам, так и по разнообразию в пространстве. Для нее характерна низкая плотность воздуха, большие...
-
В большой степени загрязнение атмосферы сказывается на здоровье городского населения. Об этом свидетельствуют, в частности, существенные различия в...
-
Характеристика промышленного объекта Реквизиты предприятия. Предприятие: Общество с ограниченной ответственностью "Мегаблок" (ООО "Мегаблок") Генеральный...
-
Животные населяют весь земной шар: сушу, пресноводные водоемы, моря и океаны. Все, что окружает животных в том месте, где они живут, называют средой...
-
Все процессы в биосфере взаимосвязаны. Человечество - лишь незначительная часть биосферы, а человек является лишь одним из видов органической жизни -...
-
Нефть и нефтепродукты Нефть и нефтепродукты являются наиболее распространенными загрязняющими веществами в Мировом океане. К началу 80-ых годов в океан...
-
В ближайшей перспективе назревает истощение жизненно важных для человеческой цивилизации сырьевых источников планеты. К этому добавляется демографический...
-
Правовая охрана животного мира - Пути загрязнения окружающей среды радиоактивными элементами
Обеспечение охраны животного мира осуществляется путем: установления запрещения и ограничений в использовании объектов животного мира, охраны среды...
-
Кислые атмосферные выпады на сушу. - Загрязнение окружающей среды и здоровье населения
Одна из острейших глобальных проблем современности и обозримого будущего - это проблема возрастающей кислотности атмосферных осадков и почвенного...
-
Питание и здоровье человека - Влияние окружающей среды на здоровье человека
Каждый из нас знает, что пища необходима для нормальной жизнедеятельности организма. В течение всей жизни в организме человека непрерывно совершается...
-
Отходы производства -- это остатки сырья, материалов, полуфабрикатов химических соединений, образовавшиеся при производстве продукции или выполнении...
Факторы окружающей среды промышленных городов, ухудшающие здоровье населения, и пути их решения